2,5-Diméthylfurane - 2,5-Dimethylfuran

|
|

|
|
| Des noms | |
|---|---|
|
Nom IUPAC préféré
2,5-Diméthylfurane |
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| Carte d'information de l'ECHA |
100.009.923 |
| Numéro CE | |
|
CID PubChem
|
|
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 6 H 8 O | |
| Masse molaire | 96.13 |
| Apparence | Liquide |
| Densité | 0,8897 g / cm 3 |
| Point de fusion | −62 °C (−80 °F; 211 K) |
| Point d'ébullition | 92 à 94 °C (198 à 201 °F ; 365 à 367 K) |
| Insoluble | |
| -66,37·10 -6 cm 3 /mol | |
|
Indice de réfraction ( n D )
|
1,44 – 1,442 |
| Dangers | |
| Principaux dangers | Très inflammable, nocif |
| point de rupture | −1 °C (30 °F; 272 K) |
| 285,85 °C (546,53 °F; 559,00 K) | |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Références de l'infobox | |
Le 2,5-diméthylfurane est un composé hétérocyclique de formule (CH 3 ) 2 C 4 H 2 O. Bien que souvent abrégé DMF , il ne doit pas être confondu avec le diméthylformamide . Dérivé du furane , ce composé simple est un biocarburant potentiel , étant dérivé de la cellulose.
Production
Le fructose peut être converti en 2,5-diméthylfurane dans un processus catalytique de biomasse en liquide . La conversion du fructose en DMF se fait via l' hydroxyméthylfurfural .
Le fructose est obtenu à partir du glucose, un élément constitutif de la cellulose.
Potentiel comme biocarburant
Le DMF présente un certain nombre d'attraits en tant que biocarburant . Il a une densité énergétique 40% supérieure à celle de l' éthanol , ce qui le rend comparable à l' essence (essence). Il est également chimiquement stable et, étant insoluble dans l'eau, n'absorbe pas l'humidité de l'atmosphère. L'évaporation du diméthylfurane pendant le processus de production nécessite également environ un tiers moins d'énergie que l'évaporation de l'éthanol, bien qu'il ait un point d'ébullition supérieur d'environ 14 °C, à 92 °C, contre 78 °C pour l'éthanol.
La capacité de produire efficacement et rapidement du diméthylfurane à partir du fructose, présent dans les fruits et certains légumes-racines , ou à partir du glucose, qui peut être dérivé de l' amidon et de la cellulose - tous largement disponibles dans la nature - ajoute à l'attrait du diméthylfurane, bien que les problèmes de sécurité doivent être examiné. Le bioéthanol et le biodiesel sont actuellement les principaux biocarburants liquides.
Le rapport air/carburant stoechiométrique du diméthylfurane est de 10,72, par rapport à l'éthanol à 8,95 et à l'essence à 14,56. Cela signifie que la combustion du diméthylfurane nécessite environ 33 % moins d'air que la même quantité d'essence, mais environ 20 % plus d'air que la même quantité d'éthanol.
Le pouvoir calorifique du diméthylfurane liquide est de 33,7 MJ/kg, contre 26,9 MJ/kg pour l'éthanol et 43,2 MJ/kg pour l'essence. L' indice d'octane de recherche (RON) du diméthylfurane est de 119. La chaleur latente de vaporisation à 20 °C est de 31,91 kJ/mol. Des tests récents dans un moteur à essence monocylindre ont révélé que l'efficacité thermique de la combustion du diméthylfurane est similaire à celle de l'essence.
Autres utilisations
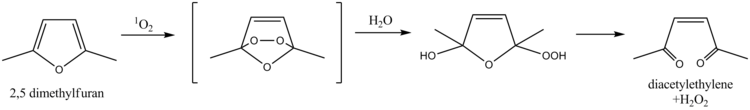
Le 2,5-diméthylfurane sert de piégeur pour l'oxygène singulet , une propriété qui a été exploitée pour la détermination de l'oxygène singulet dans les eaux naturelles. Le mécanisme implique une réaction de Diels-Alder suivie d'une hydrolyse , conduisant finalement à du diacétyléthylène et du peroxyde d'hydrogène comme produits. Plus récemment, l'alcool furfurylique a été utilisé dans le même but.
Le 2,5-diméthylfurane a également été proposé comme étalon interne pour la spectroscopie RMN . Le 2,5-diméthylfurane a des singulets dans son spectre RMN 1 H à 2,2 et 5,8; les singulets donnent des intégrations fiables, tandis que les positions des pics n'interfèrent pas avec de nombreux analytes. Le composé a également un point d'ébullition approprié de 92 °C qui empêche les pertes par évaporation, tout en s'éliminant facilement.
Rôle en chimie alimentaire
Le 2,5-diméthylfurane se forme lors de la dégradation thermique de certains sucres et a été identifié à l'état de traces comme composant des sucres caramélisés .
Toxicologie
Le 2,5-diméthylfurane joue un rôle dans le mécanisme de la neurotoxicité de l'hexane chez l'homme. Avec l' hexane-2,5-dione et la 4,5-dihydroxy-2-hexanone, c'est l'un des principaux métabolites de l' hexane .
Le 2,5-diméthylfurane a été identifié comme l'un des composants de la fumée de cigare à faible toxicité ciliaire (capacité à affecter négativement les cils des voies respiratoires responsables de l'élimination des particules étrangères). Sa concentration sanguine peut être utilisée comme biomarqueur du tabagisme .
La comparaison des fiches de données de sécurité montre que la manipulation humaine du 2,5-diméthylfurane est approximativement aussi dangereuse que la manipulation de l'essence.
