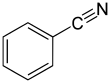
Benzonitrile - Benzonitrile
|
|
|||
| Noms | |||
|---|---|---|---|
|
Nom IUPAC préféré
Benzonitrile |
|||
|
Nom IUPAC systématique
Benzenecarbonitrile |
|||
| Autres noms | |||
| Identifiants | |||
|
Modèle 3D ( JSmol )
|
|||
| 3DMet | |||
| 506893 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Carte Info ECHA |
100.002.596 |
||
| Numéro CE | |||
| 2653 | |||
| KEGG | |||
|
PubChem CID
|
|||
| Numéro RTECS | |||
| UNII | |||
| Numéro UN | 2224 | ||
|
Tableau de bord CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriétés | |||
|
C 6 H 5 (CN) |
|||
| Masse molaire | 103,12 g / mol | ||
| Densité | 1,0 g / ml | ||
| Point de fusion | −13 ° C (9 ° F; 260 K) | ||
| Point d'ébullition | 188 à 191 ° C (370 à 376 ° F; 461 à 464 K) | ||
| <0,5 g / 100 ml (22 ° C) | |||
| -65,19 · 10 −6 cm 3 / mol | |||
|
Indice de réfraction ( n D )
|
1,5280 | ||
| Dangers | |||
| Pictogrammes SGH |

|
||
| Mot de signalisation SGH | Avertissement | ||
| H302 , H312 | |||
| P264 , P270 , P280 , P301 + 312 , P302 + 352 , P312 , P322 , P330 , P363 , P501 | |||
| NFPA 704 (diamant de feu) | |||
| point de rupture | 75 ° C (167 ° F; 348 K) | ||
| 550 ° C (1 022 ° F; 823 K) | |||
| Limites explosives | 1,4 à 7,2% | ||
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Références Infobox | |||
Le benzonitrile est le composé chimique de formule C
6 H
5 (CN) , abrégé Ph CN. Ce composé organique aromatique est un liquide incolore à l'odeur douce d'amande amère. Il est principalement utilisé comme précurseur de la résine benzoguanamine .
Production
Il est préparé par ammoxydation du toluène , c'est-à-dire sa réaction avec l' ammoniac et l'oxygène (ou l'air) entre 400 et 450 ° C (752 et 842 ° F).
-
C
6 H
5 CH
3 + 3/2 O
2 + NH
3 → C
6 H
5 (CN) + 3 H
2 O
En laboratoire, il peut être préparé par déshydratation du benzamide ou par la réaction de Rosenmund – von Braun en utilisant du cyanure cuivreux ou NaCN / DMSO et du bromobenzène .
Applications
Utilisations en laboratoire
Le benzonitrile est un solvant utile et un précurseur polyvalent de nombreux dérivés. Il réagit avec les amines pour donner des benzamides N-substitués après hydrolyse. C'est un précurseur de la diphénylcétimine Ph
2 C = NH (pb 151 ° C, 8 mm Hg) par réaction avec du bromure de phénylmagnésium suivie d'une méthanolyse .
Le benzonitrile forme des complexes de coordination avec les métaux de transition qui sont à la fois solubles dans les solvants organiques et facilement labiles. Un exemple est PdCl
2 (PhCN)
2 . Les ligands benzonitrile sont facilement déplacés par des ligands plus forts, ce qui fait des complexes benzonitrile des intermédiaires synthétiques utiles.
Histoire
Le benzonitrile a été rapporté par Hermann Fehling en 1844. Il a trouvé le composé comme un produit de la déshydratation thermique du benzoate d'ammonium . Il a déduit sa structure de la réaction analogue déjà connue du formiate d'ammonium donnant du formonitrile. Il a également inventé le nom de benzonitrile qui a donné le nom à tout le groupe des nitriles .
En 2018, du benzonitrile aurait été détecté dans le milieu interstellaire .