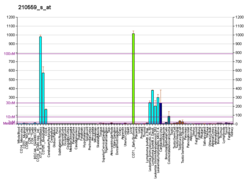
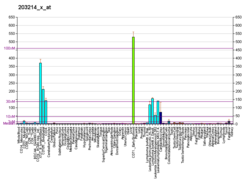
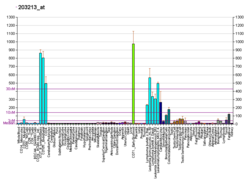
Kinase dépendante de la cycline 1 - Cyclin-dependent kinase 1
La kinase 1 dépendante de la cycline, également connue sous le nom de CDK1 ou homologue de la protéine 2 du cycle de division cellulaire, est une protéine hautement conservée qui fonctionne comme une sérine/thréonine kinase et est un acteur clé dans la régulation du cycle cellulaire . Il a été très étudié chez la levure bourgeonnante S. cerevisiae et la levure à fission S. pombe , où il est codé par les gènes cdc28 et cdc2 , respectivement. Chez l'homme, Cdk1 est codé par le gène CDC2 . Avec ses partenaires cyclines , Cdk1 forme des complexes qui phosphorylent une variété de substrats cibles (plus de 75 ont été identifiés chez la levure bourgeonnante) ; la phosphorylation de ces protéines conduit à la progression du cycle cellulaire.
Structure
Cdk1 est une petite protéine (environ 34 kilodaltons) et est hautement conservée. L'homologue humain de Cdk1, CDC2 , partage environ 63 % d'identité d'acides aminés avec son homologue de levure. De plus, le CDC2 humain est capable de sauver une levure de fission porteuse d'une mutation cdc2 . Cdk1 est composé principalement par le motif de protéine kinase nue, que d'autres protéines kinases partagent. Cdk1, comme les autres kinases, contient une fente dans laquelle s'insère l' ATP . Les substrats de Cdk1 se lient près de l'embouchure de la fente et les résidus de Cdk1 catalysent la liaison covalente du -phosphate à l'oxygène de l' hydroxyl sérine/thréonine du substrat.
En plus de ce noyau catalytique, Cdk1, comme d'autres kinases dépendantes de la cycline , contient une boucle en T, qui, en l'absence d'une cycline interagissante, empêche la liaison du substrat au site actif de Cdk1. Cdk1 contient également une hélice PSTAIRE qui, lors de la liaison de la cycline, déplace et réarrange le site actif, facilitant les activités de la kinase Cdk1.
Fonction
Lorsqu'elle est liée à ses partenaires cyclines, la phosphorylation de Cdk1 conduit à la progression du cycle cellulaire. L'activité Cdk1 est mieux comprise chez S. cerevisiae , donc l'activité Cdk1 S. cerevisiae est décrite ici.
Chez la levure bourgeonnante, l'entrée initiale du cycle cellulaire est contrôlée par deux complexes régulateurs, le SBF (SCB-binding factor) et le MBF (MCB-binding factor). Ces deux complexes contrôlent la transcription du gène G 1 /S ; cependant, ils sont normalement inactifs. Le SBF est inhibé par la protéine Whi5 ; cependant, lorsqu'il est phosphorylé par Cln3-Cdk1, Whi5 est éjecté du noyau, permettant la transcription du régulon G 1 /S , qui comprend les cyclines G 1 /S Cln1,2. L'activité G 1 /S cycline-Cdk1 entraîne une préparation à l'entrée en phase S (par exemple, duplication des centromères ou du corps polaire du fuseau) et une augmentation des cyclines S (Clb5,6 dans S. cerevisiae ). Les complexes Clb5,6-Cdk1 conduisent directement à l'initiation de l'origine de réplication ; cependant, ils sont inhibés par Sic1 , empêchant l'initiation prématurée de la phase S.
L'activité du complexe Cln1,2 et/ou Clb5,6-Cdk1 entraîne une chute brutale des niveaux de Sic1, permettant une entrée cohérente en phase S. Enfin, la phosphorylation par les cyclines M (par exemple, Clb1, 2, 3 et 4) en complexe avec Cdk1 conduit à l'assemblage du fuseau et à l'alignement des chromatides sœurs. La phosphorylation de Cdk1 conduit également à l'activation de l'ubiquitine-protéine ligase APC Cdc20 , une activation qui permet la ségrégation des chromatides et, en outre, la dégradation des cyclines en phase M. Cette destruction des cyclines M conduit aux événements finaux de la mitose (par exemple, le désassemblage du fuseau, la sortie mitotique).
Régulation
Compte tenu de son rôle essentiel dans la progression du cycle cellulaire, Cdk1 est hautement régulée. De toute évidence, Cdk1 est régulé par sa liaison avec ses partenaires cyclines. La liaison à la cycline modifie l'accès au site actif de Cdk1, permettant l'activité de Cdk1 ; en outre, les cyclines confèrent une spécificité à l'activité de Cdk1. Au moins certaines cyclines contiennent un patch hydrophobe qui peut interagir directement avec les substrats, conférant une spécificité de cible. De plus, les cyclines peuvent cibler Cdk1 vers des emplacements subcellulaires particuliers.
En plus de la régulation par les cyclines, Cdk1 est régulée par phosphorylation. Une tyrosine conservée (Tyr15 chez l'homme) conduit à l'inhibition de Cdk1 ; on pense que cette phosphorylation modifie l'orientation de l'ATP, empêchant une activité kinase efficace. Chez S. pombe, par exemple, une synthèse incomplète de l'ADN peut conduire à une stabilisation de cette phosphorylation, empêchant la progression mitotique. Wee1 , conservé chez tous les eucaryotes phosphoryle Tyr15, alors que les membres de la famille Cdc25 sont des phosphatases, contrecarrant cette activité. On pense que l'équilibre entre les deux aide à régir la progression du cycle cellulaire. Wee1 est contrôlé en amont par Cdr1, Cdr2 et Pom1 .
Les complexes Cdk1-cycline sont également régis par la liaison directe des protéines inhibitrices de Cdk (CKI). Une telle protéine, déjà discutée, est Sic1. Sic1 est un inhibiteur stoechiométrique qui se lie directement aux complexes Clb5,6-Cdk1. La phosphorylation multisite, par Cdk1-Cln1/2, de Sic1 est censée chronométrer l'ubiquitination et la destruction de Sic1, et par extension, le moment de l'entrée en phase S. Ce n'est que jusqu'à ce que l'inhibition de Sic1 soit surmontée que l'activité Clb5,6 se produise et que l'initiation de la phase S puisse commencer.
Interactions
Il a été démontré que Cdk1 interagit avec :
Voir également
Mastl
Les références
Lectures complémentaires
- Draetta G, Eckstein J (1997). « Cdc25 protéine phosphatases dans la prolifération cellulaire ». Biochim. Biophys. Acta . 1332 (2) : M53-63. doi : 10.1016/S0304-419X(96)00049-2 . PMID 9141461 .
- Kino T, Pavlakis GN (2004). "Molécules partenaires de la protéine accessoire Vpr du virus de l'immunodéficience humaine de type 1" . ADN Cell Biol . 23 (4) : 193-205. doi : 10.1089/104454904773819789 . PMID 15142377 .
- Kino T, Chrousos GP (2004). « Protéine accessoire Vpr du virus de l'immunodéficience humaine de type 1 : un agent causal du syndrome de résistance à l'insuline/lipodystrophie lié au SIDA ? » . Anne. NY Acad. Sci . 1024 (1) : 153-167. Bibcode : 2004NYASA1024..153K . doi : 10.1196/annals.1321.013 . PMID 15265780 . S2CID 23655886 .
- Zhao LJ, Zhu H (2005). « Structure et fonction de la protéine régulatrice auxiliaire Vpr du VIH-1 : nouveaux indices pour la conception de médicaments ». Cour. Médicament Cibles Immunitaire Endocr. Métabol. Désordre . 4 (4) : 265-275. doi : 10.2174/1568008043339668 . PMID 15578977 .
- Le Rouzic E, Benichou S (2006). « La protéine Vpr du VIH-1 : rôles distincts tout au long du cycle de vie viral » . Rétrovirologie . 2 : 11. doi : 10.1186/1742-4690-2-11 . PMC 554975 . PMID 15725353 .
- Zhao RY, Elder RT (2005). "Infections virales et régulation G2/M du cycle cellulaire" . Rés Cell . 15 (3) : 143-149. doi : 10.1038/sj.cr.7290279 . PMID 15780175 .
- Zhao RY, Bukrinsky M, Elder RT (2005). « Protéine virale R du VIH-1 (Vpr) et réponses cellulaires de l'hôte ». Indien J. Med. Rés . 121 (4) : 270-86. PMID 15817944 .
- Kaldis P, Aleem E (2007). « Rivalité fraternelle du cycle cellulaire : Cdc2 contre Cdk2 » . Cycle cellulaire . 4 (11) : 1491-1494. doi : 10.4161/cc.4.11.2124 . PMID 16258277 .
- Li L, Li HS, Pauza CD, Bukrinsky M, Zhao RY (2006). "Rôles des protéines auxiliaires du VIH-1 dans la pathogenèse virale et les interactions hôte-pathogène" . Rés Cell . 15 (11-12) : 923-934. doi : 10.1038/sj.cr.7290370 . PMID 16354571 .
- Rietbrock N, Keller F (1977). "[Disponibilité biologique et effet de "1er passage" des médicaments]". Fortschr. Méd . 95 (28) : 1765–6, 1774–80. PMID 914146 .
- Azzi L, Meijer L, Reed SI, Pidikiti R, Tung HY (1992). "Interaction entre les protéines de contrôle du cycle cellulaire p34cdc2 et p9CKShs2. Preuve de deux domaines de liaison coopératifs dans p9CKShs2" . EUR. J. Biochem . 203 (3) : 353-360. doi : 10.1111/j.1432-1033.1992.tb16557.x . PMID 1310466 .
- Dutta A, Stillman B (1992). "Les kinases de la famille cdc2 phosphorylent un facteur de réplication de l'ADN des cellules humaines, la RPA, et activent la réplication de l'ADN" . EMBO J . 11 (6) : 2189–99. doi : 10.1002/j.1460-2075.1992.tb05278.x . PMC 556686 . PMID 1318195 .
- Koff A, Giordano A, Desai D, Yamashita K, Harper JW, Elledge S, Nishimoto T, Morgan DO, Franza BR, Roberts JM (1992). « Formation et activation d'un complexe cycline E-cdk2 pendant la phase G1 du cycle cellulaire humain ». Sciences . 257 (5077) : 1689-1694. Bibcode : 1992Sci ... 257.1689K . doi : 10.1126/science.1388288 . PMID 1388288 .
- Russo GL, Vandenberg MT, Yu IJ, Bae YS, Franza BR, Marshak DR (1992). "La caséine kinase II phosphoryle la p34cdc2 kinase en phase G1 du cycle de division cellulaire HeLa" . J. Biol. Chem . 267 (28) : 20317-25. doi : 10.1016/S0021-9258 (19) 88704-5 . PMID 1400350 .
- Rubinfeld B, Croisier WJ, Albert I, Conroy L, Clark R, McCormick F, Polakis P (1992). "Localisation du domaine catalytique rap1GAP et des sites de phosphorylation par analyse mutationnelle" . Mol. Cellule. Biol . 12 (10) : 4634-42. doi : 10.1128/MCB.12.10.4634 . PMC 360390 . PMID 1406653 .
- van der Sluijs P, Hull M, Huber LA, Mâle P, Goud B, Mellman I (1992). "La phosphorylation réversible - la déphosphorylation détermine la localisation de rab4 au cours du cycle cellulaire" . EMBO J . 11 (12) : 4379-89. doi : 10.1002/j.1460-2075.1992.tb05538.x . PMC 557012 . PMID 1425574 .
- Seth A, Alvarez E, Gupta S, Davis RJ (1992). "Un site de phosphorylation situé dans le domaine NH2-terminal de c-Myc augmente la transactivation de l'expression génique" . J. Biol. Chem . 266 (35) : 23521-4. doi : 10.1016/S0021-9258 (18) 54312-X . PMID 1748630 .
- Lees JA, Buchkovich KJ, Marshak DR, Anderson CW, Harlow E (1992). "La protéine du rétinoblastome est phosphorylée sur plusieurs sites par le cdc2 humain" . EMBO J . 10 (13) : 4279-90. doi : 10.1002/j.1460-2075.1991.tb05006.x . PMC 453181 . PMID 1756735 .
- Nazarenko SA, Ostroverhova NV, Spurr NK (1991). « Affectation régionale du gène de contrôle du cycle cellulaire humain CDC2 au chromosome 10q21 par hybridation in situ ». Hum. Genet . 87 (5) : 621-2. doi : 10.1007/BF00209025 . PMID 1916766 . S2CID 25673088 .
- Nissen MS, Langan TA, Reeves R (1991). "La phosphorylation par la kinase cdc2 module l'activité de liaison à l'ADN de la protéine de chromatine non histone du groupe I à haute mobilité" . J. Biol. Chem . 266 (30) : 19945-52. doi : 10.1016/S0021-9258 (18) 54874-2 . PMID 1939057 .