Fluorure de cobalt (II) - Cobalt(II) fluoride
|
|
|
|
| Des noms | |
|---|---|
|
Nom IUPAC
Fluorure de cobalt (II)
|
|
| Autres noms
difluorure de cobalt
|
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChemSpider | |
| Carte Info ECHA |
100.030.044 |
| Numéro CE | |
|
PubChem CID
|
|
| Numéro RTECS | |
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| Co F 2 | |
| Masse molaire | 96,93 g / mol |
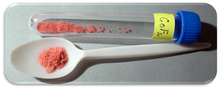
| Apparence | Solide cristallin rouge |
| Densité | 4,46 g / cm 3 (anhydre) 2,22 g / cm 3 (tétrahydraté) |
| Point de fusion | 1 217 ° C (2 223 ° F; 1 490 K) |
| Point d'ébullition | 1 400 ° C (2 550 ° F; 1 670 K) |
| 1,4 g / 100 ml (25 ° C) | |
| Solubilité | soluble dans HF insoluble dans l' alcool , l' éther , le benzène |
| + 9490,0 · 10 −6 cm 3 / mol | |
| Structure | |
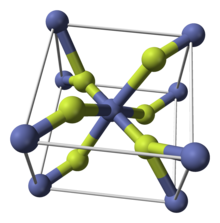
| tétragonal (a, hydraté) orthorhombique (tétrahydraté) |
|
| Dangers | |
| NFPA 704 (diamant de feu) | |
| Dose ou concentration létale (DL, LC): | |
|
DL 50 ( dose médiane )
|
oral (rat): 150 mg / kg |
| Composés apparentés | |
|
Autres anions
|
cobalt (II) oxyde , le chlorure de cobalt (II) |
|
Autres cations
|
le fluorure de fer (II) , nickel (II) de fluorure |
|
Composés apparentés
|
trifluorure de cobalt |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Références Infobox | |
Le fluorure de cobalt (II) est un composé chimique de formule (CoF 2 ). C'est un composé solide cristallin rose qui est antiferromagnétique à basse température (T N = 37,7 K) La formule est donnée à la fois pour le cristal tétragonal rouge, (CoF 2 ), et le cristal orthogonal rouge tétrahydraté, (CoF 2 · 4H 2 O ). Le CoF 2 est utilisé dans les domaines sensibles à l'oxygène, à savoir la production de métaux. En faibles concentrations, il a des usages de santé publique. Le CoF 2 est peu soluble dans l'eau. Le composé peut être dissous dans de l'acide minéral chaud et se décomposera dans l'eau bouillante. Or l'hydrate est hydrosoluble, en particulier les formes dihydrate CoF 2 · 2H 2 O et trihydrate CoF 2 · 3H 2 O du composé. L'hydrate se décomposera également avec la chaleur.
Préparation
Le fluorure de cobalt (II) peut être préparé à partir de chlorure de cobalt (II) ou d'oxyde de cobalt (II) anhydre dans un courant de fluorure d'hydrogène :
- CoCl 2 + 2HF → CoF 2 + 2HCl
- CoO + 2HF → CoF 2 + H 2 O
Il est produit par la réaction du fluorure de cobalt (III) avec de l'eau.
Le fluorure de cobalt (II) tétrahydraté est formé par dissolution du cobalt (II) dans l'acide fluorhydrique. Le fluorure anhydre peut en être extrait par déshydratation . Une autre synthèse peut se produire à des températures plus élevées. Il a été montré qu'à 500 ° C le fluor se combinera avec le cobalt produisant un mélange de CoF 2 et CoF 3 .
Les usages
Le fluorure de cobalt (II) peut être utilisé comme catalyseur pour allier les métaux. Il est également utilisé pour le dépôt optique, dont il améliore considérablement la qualité optique. Le fluorure de cobalt (II) est disponible dans la plupart des volumes dans une composition de très haute pureté. Les compositions de haute pureté améliorent les qualités optiques et son utilité en tant que norme.
Analyse
Pour analyser ce composé, le fluorure de cobalt (II) peut être dissous dans l'acide nitrique. La solution est ensuite diluée avec de l'eau jusqu'à concentration appropriée pour la spectrophotométrie AA ou ICP pour le cobalt. Une petite quantité de sel peut être dissoute dans de l'eau froide et analysée pour l'ion fluorure par une électrode sélective d'ions fluorure ou par chromatographie ionique .
Propriétés chimiques
CoF 2 est un acide de Lewis faible . Les complexes de cobalt (II) sont généralement octaédriques ou tétraédriques. En tant qu'espèce à 19 électrons, c'est un bon agent réducteur, assez oxydable en un composé à 18 électrons. Le fluorure de cobalt (II) peut être réduit par l'hydrogène à 300 ° C.
Les références
- ^ Pradyot Patnaik (2002), Manuel des produits chimiques inorganiques , McGraw-Hill Professional, ISBN 978-0-07-049439-8
- ^ Pachkevich, DS; Radchenko SM; Mukhortov, DA, "Article title Heat Exchange between Cobalt (II) Fluoride Powder and the Wall of Rotating Cylinder" (PDF) , Russian Journal of Applied Chemistry , Consultants Bureau, ISSN 1070-4272 , archivé de l'original (PDF) en 2004 -09-29 , récupéré 2007-03-07
- ^ Ashcroft / Mermin: Physique du solide (Tab.33.2)
- ^ JC Bailar (1973), Chimie inorganique complète , Pergoamon

