Famille ADF/Cofilin - ADF/Cofilin family
L'ADF/cofiline est une famille de protéines de liaison à l'actine associées à la dépolymérisation rapide des microfilaments d'actine qui confèrent à l'actine son instabilité dynamique caractéristique . Cette instabilité dynamique est au cœur du rôle de l'actine dans la contraction musculaire, la motilité cellulaire et la régulation de la transcription.
Trois gènes hautement conservés et hautement identiques (70 % à 82 %) appartenant à cette famille ont été décrits chez l'homme et la souris :
- CFL1 , codant pour la cofiline 1 (non musculaire ou n-cofiline)
- CFL2 , codant pour la cofiline 2 (trouvée dans le muscle : m-cofiline)
- DSTN , codant pour la destrine , également appelée ADF ou facteur de dépolymérisation de l' actine
Les protéines de liaison à l' actine régulent l'assemblage et le désassemblage des filaments d'actine. La cofiline , un membre de la famille ADF/cofiline, est en fait une protéine avec 70 % d'identité de séquence avec la destrine , ce qui en fait une partie de la famille ADF/cofiline des petites protéines liant l'ADP. La protéine se lie aux monomères et filaments d'actine, respectivement l'actine G et l'actine F. La cofiline provoque une dépolymérisation à l'extrémité négative des filaments, empêchant ainsi leur réassemblage. La protéine est connue pour couper les filaments d'actine en créant des extrémités plus positives sur les fragments de filament. La cofiline/ADF (destrine) est susceptible de couper la F-actine sans coiffage et préfère l'ADP-actine. Ces monomères peuvent être recyclés par la profiline , activant les monomères pour qu'ils redeviennent sous forme de filament par un échange ADP en ATP . L'ATP-actine est alors disponible pour l'assemblage.
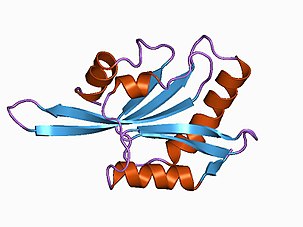
Structure
La structure des facteurs de dépolymérisation de l'actine est hautement conservée dans de nombreux organismes en raison de l'importance de l'actine dans de nombreux processus cellulaires. Les protéines de la famille des facteurs de dépolymérisation de l'actine se composent de manière caractéristique de cinq feuillets bêta, quatre antiparallèles et un parallèle, et quatre hélices alpha avec une hélice alpha centrale fournissant la structure et la stabilité des protéines. Le domaine d'homologie du facteur de dépolymérisation de l'actine (domaine ADF-H) permet la liaison aux sous-unités d'actine et comprend l'hélice alpha centrale, l'extension N-terminale et l'hélice C-terminale.
- L'extension N-terminale consiste en une boucle inclinée qui facilite la liaison à la G-actine mais pas à la F-actine en raison de l'encombrement stérique présent dans la F-actine.
- L'extrémité C-terminale peut former des liaisons hydrogène avec l'actine F via son squelette amide et une sérine en position S274. Cette sérine est particulièrement hautement conservée au cours de l'évolution en raison de son importance dans la liaison de l'actine.
- L'hélice alpha centrale est insérée dans la fente hydrophobe entre les première et troisième sous-unités d'actine pendant la liaison de l'actine.
La cofiline se lie à l'actine monomère (G-actine) et filamenteuse (F-actine). Ses affinités de liaison sont plus élevées pour l'ADP-actine que pour l'ADP-Pi et l'ATP-actine. Sa liaison modifie la torsion de la F-actine. La structure d'ADF a été caractérisée pour la première fois en 1980 par James Bamburg. Quatre histidines d'actine près du site de liaison de la cofiline peuvent être nécessaires pour l'interaction cofiline/actine, mais la sensibilité au pH à elle seule peut ne pas suffire à expliquer les niveaux d'interaction rencontrés. La cofiline est logée dans l'actine ADP-F en raison de la flexibilité accrue de cette forme d'actine. La liaison par la cofiline et l'ADF (destrine) entraîne une réduction de la longueur de croisement du filament. Par conséquent, les souches augmentent la dynamique des filaments et le niveau de fragmentation des filaments observé.
Une fonction
La cofiline est un facteur de liaison à l'actine ubiquitaire nécessaire à la réorganisation des filaments d'actine. Les membres de la famille ADF/Cofilin se lient aux monomères d'actine G et dépolymérisent les filaments d'actine par le biais de deux mécanismes : la séparation et l'augmentation du taux de rupture des monomères d'actine à partir de l'extrémité pointue. Des filaments d'actine ADP/ADP-Pi "plus anciens" exempts de tropomyosine et un pH approprié sont nécessaires pour que la cofiline fonctionne efficacement. En présence d'ATP-G-actine facilement disponible, la cofiline accélère la polymérisation de l'actine via son activité de séparation de l'actine (fournissant des extrémités barbelées libres pour une polymérisation et une nucléation ultérieures par le complexe Arp2/3). En tant qu'effet in vivo de longue durée , la cofiline recycle l'ADP-F-actine plus ancienne, aidant la cellule à maintenir le pool d'ATP-G-actine pour une motilité soutenue. Le pH, la phosphorylation et les phosphoinositides régulent l'activité de liaison et d'association de la cofiline avec l'actine
Le complexe Arp2/3 et la cofiline agissent ensemble pour réorganiser les filaments d'actine dans le cytosquelette . Arp 2/3, un complexe de protéines liant l'actine, se lie au côté de l'ATP-F-actine près de l'extrémité barbelée en croissance du filament, provoquant la nucléation d'une nouvelle branche F-actine, tandis que la dépolymérisation induite par la cofiline a lieu après dissociation de le complexe Arp2/3. Ils travaillent également ensemble pour réorganiser les filaments d'actine afin de faire circuler plus de protéines par vésicule pour poursuivre la croissance des filaments.
La cofiline se lie également à d'autres protéines telles que la myosine , la tropomyosine , la -actinine , la gelsoline et le scruin . Ces protéines entrent en compétition avec la cofiline pour la liaison de l'actine. La Сofiline joue également un rôle dans la réponse immunitaire innée.
Dans un organisme modèle
L'ADF/cofiline se trouve dans les membranes ébouriffantes et au bord d'attaque des cellules mobiles. En particulier, l'ADF/cofiline favorise le désassemblage du filament à l'arrière de la brosse chez Xenopus laevis lamellipodia , une saillie des cellules fibroblastiques caractérisée par des réseaux d'actine. Des sous-unités sont ajoutées aux extrémités barbelées et perdues des extrémités pointues orientées vers l'arrière. L'augmentation de la constante de vitesse, k, pour la dissociation de l'actine des extrémités pointues s'est avérée couper les filaments d'actine. Grâce à cette expérimentation, il a été découvert que l'ATP ou l'ADP-Pi sont probablement impliqués dans la liaison aux filaments d'actine.
Mécanisme d'action
La F-actine (actine filamenteuse) est stabilisée lorsqu'elle est liée à l'ATP en raison de la présence d'une sérine sur la deuxième sous-unité d'actine capable de former des liaisons hydrogène avec le dernier groupe phosphate de l'ATP et une histidine voisine liée au principal boucle. Cette interaction stabilise la structure en interne grâce aux interactions entre la boucle principale et la deuxième sous-unité. Lorsque l'ATP est hydrolysé en ADP, la sérine ne peut plus former de liaison hydrogène avec l'ADP en raison de la perte du phosphate inorganique qui provoque la torsion de la chaîne latérale de la sérine, provoquant un changement de conformation dans la deuxième sous-unité. Ce changement de conformation empêche également la sérine de former une liaison hydrogène avec l'histidine attachée à la boucle principale, ce qui affaiblit la liaison entre les sous-unités un et trois, provoquant la torsion de la molécule entière. Cette torsion met la molécule à rude épreuve et la déstabilise.
Le facteur de dépolymérisation de l'actine est capable de se lier à la F-actine déstabilisée en insérant l'hélice centrale dans la fente entre les première et troisième sous-unités d'actine. Le facteur de dépolymérisation de l'actine lie la F-actine de manière coopérative et induit un changement de conformation de la F-actine qui l'amène à se tordre davantage et à devenir plus déstabilisé. Cette torsion provoque la rupture de la liaison entre les monomères d'actine, dépolymérisant le filament.
Régulation
Phosphorylation
Le facteur de dépolymérisation de l'actine est régulé par la phosphorylation d'une sérine sur l'extrémité C-terminale par les kinases LIM . Le facteur de dépolymérisation de l'actine est activé lorsqu'il est déphosphorylé et inhibé lorsqu'il est phosphorylé.
pH
Un environnement alcalin stabilise le phosphate inorganique libéré lorsque l'ATP est hydrolysé en ADP, donc un pH plus élevé augmente la favorabilité de l'ATP lié à la F-actine à être hydrolysé en ADP, entraînant la déstabilisation de l'actine.
Liaison à la tropomyosine
La F-actine se lie à la protéine tropomyosine et au facteur de dépolymérisation de l'actine de manière compétitive et mutuellement exclusive. La liaison de la tropomyosine à la tropomyosine n'est pas coopérative. Par conséquent, la liaison de la tropomyosine n'induit pas de changement de conformation de la F-actine et ne la déstabilise pas. Cependant, comme la F-actine ne peut pas se lier à la fois à la tropomyosine et au facteur de dépolymérisation de l'actine en raison du blocage du site de liaison du facteur de dépolymérisation de l'actine lorsqu'elle est liée à l'actine, la tropomyosine agit comme un protecteur de l'actine contre la dépolymérisation.