Cyanophage - Cyanophage
Les cyanophages sont des virus qui infectent les cyanobactéries , également appelées Cyanophyta ou algues bleu-vert. Les cyanobactéries sont un phylum de bactéries qui tirent leur énergie du processus de photosynthèse . Bien que les cyanobactéries se métabolisent de manière photoautotrophe comme les plantes eucaryotes, elles ont une structure cellulaire procaryote . Les cyanophages peuvent être trouvés dans les environnements d'eau douce et marins. Les cyanophages marins et d'eau douce ont des têtes icosaédriques , qui contiennent de l'ADN double brin, attaché à une queue par des protéines de connexion. La taille de la tête et de la queue varie selon les espèces de cyanophages. Les cyanophages infectent un large éventail de cyanobactéries et sont des régulateurs clés des populations de cyanobactéries dans les environnements aquatiques, et peuvent aider à prévenir les proliférations de cyanobactéries dans les écosystèmes d'eau douce et marins. Ces proliférations peuvent constituer un danger pour les humains et les autres animaux, en particulier dans les lacs d'eau douce eutrophes . L'infection par ces virus est très répandue dans les cellules appartenant à Synechococcus spp. dans les environnements marins, où jusqu'à 5 % des cellules appartenant à des cellules cyanobactériennes marines ont été signalées comme contenant des particules de phage mature.
Le premier cyanophage LPP-1 décrit a été signalé par Safferman et Morris en 1963. Les cyanophages sont classés dans les familles de bactériophages Myoviridae (par exemple AS-1 , N-1 ), Podoviridae (par exemple LPP-1 ) et Siphoviridae (par exemple S-1 ).
Nomenclature
Les trois familles de cyanophages suivantes ont été reconnues par le Comité international de taxonomie des virus (ICTV) : Myoviridae , Siphoviridae et Podoviridae ; contiennent tous de l'ADN double brin. Initialement, les cyanophages portaient le nom de leurs hôtes. Cependant, la capacité des cyanophages à infecter plusieurs hôtes et l'absence d'un système de nommage universel peuvent entraîner des difficultés avec leur classification taxonomique. De nombreux autres systèmes de classification utilisaient des propriétés sérologiques, morphologiques ou physiologiques. Actuellement, la procédure suggérée pour nommer les souches est la suivante : Cyanophage Xx-YYZaa, où Xx est les deux premières lettres des noms de genre et d'espèce de l'hôte dans lequel se trouve le phage du spécimen type, YY est l'origine du spécimen, Z est la famille du virus et aa est le numéro de référence du virus.
Morphologie
Comme tous les autres bactériophages à queue, les cyanophages ont une queue et une capside protéique entourant le matériel génétique. L'ADN double brin a une longueur d'environ 45 kpb et, dans certains cyanophages, code pour des gènes photosynthétiques, une intégrase ou des gènes impliqués dans le métabolisme du phosphate (inductibles par le phosphate). La queue lie le virus à la cellule hôte et transfère l'ADN viral à la cellule hôte lors de l'infection. Sur la base des caractéristiques morphologiques, les cyanophages sont classés dans les familles Myoviridae, Podoviridae et Siphoviridae, et bien qu'ils ne soient pas officiellement reconnus par le Comité international de taxonomie des virus , les cyanophages ont historiquement été classés en cyanovirus, cyanopodovirus ou cyanostylovirus en fonction duquel des trois familles dans lesquelles ils sont regroupés.
Cyanomyovirus
L'espèce type du Cyanomyovirus de la famille des Myoviridae est le Cyanophage AS-1, qui a été isolé d'un étang de stabilisation des déchets, et a également été le premier genre reconnu. Les queues ont été observées comme contractiles ou non contractiles avec des longueurs de 20 à 244 nm, des largeurs de 15 à 23 nm et une plage de rétrécissement de 93 nm. Les cyanophages ont généralement des têtes hexagonales isométriques avec des diamètres allant de 55 à 90 nm. Il existe une grande variation morphologique dans ce groupe, ce qui suggère qu'ils infectent une variété d'espèces hôtes. Au point d'attache entre la longue queue et la tête, il y a une plaque de base où sont fixées des broches courtes, une gaine contractile et un noyau interne, similaire aux autres bactériophages des Myoviridae.
Cyanopodvirus
Les cyanopodovirus, au sein des Podoviridae , sont présents à la fois dans les eaux douces et marines. L'échantillon type de cyanopodovirus est le cyanophage LPP-1, qui infecte Lyngbya , Plectonema et Phormidium . Leurs capsides sont des polyèdres qui apparaissent hexagonaux en 2D. Les queues sont creuses avec une symétrie radiale sextuple constituées d'anneaux de six sous-unités d'orientation inconnue. Semblables aux cyanomyovirus, ils peuvent être trouvés dans des bassins de stabilisation des déchets et ont des capsides isométriques de taille similaire mais des queues plus courtes.
Cyanostylovirus
Les cyanostylovirus appartiennent à la famille des Siphoviridae , dont l'espèce type est le cyanophage S-1, connu pour infecter Synechococcus . Les Cyanostyloviridae ont des capsides isométriques plus petites (50 nm de diamètre) que les genres précédents mais des queues plus longues (140 nm). D'autres genres de cette famille ont des queues de 200 à 300 nm de longueur.
Hôte
La gamme d'hôtes des cyanophages est très complexe et on pense qu'elle joue un rôle important dans le contrôle des populations de cyanobactéries . Il a été rapporté que les cyanophages d'eau douce infectent les hôtes de plus d'un genre, bien que cela puisse également refléter des problèmes dans la classification taxonomique de leurs hôtes. Néanmoins, ils ont été classés en trois grands groupes en fonction de la taxonomie de leur organisme hôte .
Groupe LPP
Le premier groupe est le LPP, qui appartient aux cyanopodovirus. Ce groupe de virus comprend l'isolat de cyanophage d'origine qui a infecté les « algues bleu-vert ». Les cyanophages de ce groupe sont faciles à isoler de l'environnement. Ils portent des queues courtes non contractiles et provoquent la lyse de plusieurs espèces au sein de trois genres de cyanobactéries : Lyngbya , Plectonema et Phormidium . Ainsi, le nom LPP est dérivé des trois genres d'hôtes qu'ils infectent. LPP-1 et LPP-2 sont deux types principaux de cyanhophages LPP. Ce groupe de cyanophages a le même hôte même gamme ; cependant, leur sérum et autres fluides corporels ne sont pas les mêmes.
Groupe AS et SM
Les groupes AS et SM représentent le troisième groupe de cyanophages classés en fonction de la gamme d'hôtes. Ce groupe de virus serait la « nouvelle algue bleu-vert » et infecte les formes unicellulaires des cyanobactéries . Le myovirus AS-1 infecte Anacystis nidulans , Synechococcus cedrorum , Synechococcus elongatus et Microcystis aeruginosa . De même, les algues unicellulaires bleu-vert Synechococcus elongatus et Microcystis aeruginosa sont infectées par le podovirus SM-1. Il existe un nouveau groupe de virus SM, connu sous le nom de SM-2, qui lyse également Microcystis aeruginosa .
Groupe A, AN, N et NP
Les cyanophages classés dans les groupes A, AN, N et NP représentent un deuxième groupe de cyanophages classés en fonction de la gamme d'hôtes. Ils jouent un rôle important dans l'infection et la lyse des membres des genres Nostoc , Anabaena et Plectonema . Le groupe A du virus provoque la lyse et infecte les espèces Anabaena . De même, la gamme d'hôtes du groupe AN comprend à la fois les espèces Anabaena et Nostoc ; alors que le groupe N de virus infecte uniquement les espèces Nostoc et comprend le cyanophage N-1 . Le cyanophage N-1 est remarquable en ce qu'il code une puce CRISPR fonctionnelle qui peut immuniser l'hôte contre l'infection par les cyanophages concurrents. Enfin, les isolats cyanobactériens des espèces Nostoc et Plectonema sont infectés par le groupe de virus NP. Ces isolats de cyanobactéries sont étroitement liés au groupe taxonomique de Nostoc . Ils ont tous une large gamme d'hôtes et des mutations sont perceptibles dans ces groupes de virus.
Réplication
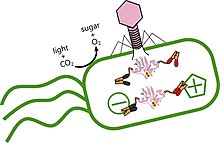
La réplication des cyanophages a deux cycles dominants : le cycle lytique et le cycle lysogène . La réplication virale des acides nucléiques et la synthèse immédiate de la protéine codée par le virus sont considérées comme le cycle lytique. Les phages sont considérés comme lytiques s'ils n'ont que la capacité d'entrer dans le cycle lytique ; tandis que le phage tempéré peut soit entrer dans le cycle lytique, soit s'intégrer de manière stable au génome de l'hôte et entrer dans le cycle lysogène. Pour répondre à la demande métabolique de réplication, les virus recrutent une multitude de stratégies pour séquestrer les nutriments de leur hôte. Une de ces techniques consiste à affamer leur cellule hôte. Cela se fait en inhibant la fixation du CO 2 des cellules hôtes , ce qui permet au cyanophage de recruter du redox et de l'ATP formés par photosynthèse de la cellule hôte pour répondre à leur réponse nucléotidique et métabolique. De nombreux cyanophages contiennent des gènes connus sous le nom de gènes métaboliques auxiliaires codés par des virus (AMG), qui codent pour les étapes critiques limitant la vitesse de l'organisme hôte. Les AMG codent des gènes pour la voie des pentoses phosphates, l'acquisition du phosphate, le métabolisme du soufre et le traitement de l'ADN/ARN ; ces gènes interfèrent avec le métabolisme de la cellule hôte. L'analyse métagénomique soutient fortement l'idée que ces gènes favorisent la réplication virale par la dégradation de l'ADN et de l'ARN de l'hôte, ainsi qu'un changement du métabolisme de la cellule hôte vers la biosynthèse des nucléotides. Les cyanophages utilisent également ces gènes pour maintenir la photosynthèse de l'hôte tout au long de la progression de l'infection, faisant passer l'énergie de la fixation du carbone à l'anabolisme, dont le virus tire parti. Les AMG codent également pour les protéines, qui aident à la réparation du photosystème hôte, qui est sensible à la photodégradation. Un exemple est celui des protéines D1 qui remplacent la protéine D1 de la cellule hôte lorsqu'elle est endommagée. Le virus régule à la hausse la photosynthèse, ce qui entraîne une augmentation du taux de dégradation de la protéine D1, la cellule hôte à elle seule ne peut pas remplacer efficacement ces protéines, de sorte que le cyanophage les remplace pour la cellule hôte, lui permettant de continuer à fournir de l'énergie pour le cycle de réplication du cyanophage.
Il est évident que la réplication des cyanophages dépend fortement du cycle journalier. La première étape du cycle infectieux consiste pour le cyanophage à entrer en contact et à se lier aux cyanobactéries, ce processus d'adsorption dépend fortement de l'intensité lumineuse. Des études de terrain montrent également que l'infection et la réplication des cyanophages sont directement ou indirectement synchronisées avec le cycle lumière-obscurité.
Adhérence
Les cyanophages, comme les autres bactériophages, s'appuient sur le mouvement brownien pour entrer en collision avec les bactéries, puis utilisent des protéines de liaison aux récepteurs pour reconnaître les protéines de surface cellulaire, ce qui conduit à l'adhérence. Les virus à queue contractile s'appuient ensuite sur des récepteurs trouvés sur leur queue pour reconnaître les protéines hautement conservées à la surface de la cellule hôte. Les cyanophages ont également plusieurs protéines de surface avec des domaines de type Ig, qui sont utilisées pour l'adhérence.
Certains cyanophages produisent également une structure en forme de corne, qui fait saillie du sommet opposé à la queue. La structure en forme de corne est supposée aider à l'attachement aux cellules dans l'environnement naturel; cependant, cela n'a pas été confirmé.
Cycle lytique
Les cyanophages peuvent subir à la fois des cycles lytiques et lysogènes selon les virus et leur environnement. Dans une étude sur les cyanomyovirus infectant les Synechococcus sp. marins , la phase lytique a duré environ 17 heures, le nombre moyen de virus produits pour chaque cellule lysée (taille de la rafale) allant de 328 sous une lumière élevée à 151 sous une lumière faible. Il existe des preuves soutenant la prémisse qu'il existe une corrélation entre l'intensité lumineuse et la taille de l'éclatement. Des études montrent que la réplication des cyanophages est entraînée par l'énergie du métabolisme photosynthétique de la cellule hôte. La lyse de la cellule hôte a tendance à se produire après l'achèvement de la réplication de l'ADN de l'hôte et immédiatement avant la division cellulaire. Cela est dû à la disponibilité accrue des ressources pour la réplication des particules virales.
Importance écologique
Écosystème
Certains cyanophages infectent et éclatent Prochlorococcus , les producteurs primaires les plus petits et les plus abondants au monde. Les cyanophages marins de la famille des Myoviridae aident à réguler la production primaire principalement par l'infection de Synechococcus spp. Les deux autres familles, les Podoviridés et les Siphoviridae , se trouvent généralement dans les écosystèmes d'eau douce. Dans les océans côtiers, l'abondance des virus infectant Synechococcus spp. peut atteindre >10 6 mL -1 et 10 5 g -1 dans les sédiments. On estime que 3% des Synechococcus sont éliminés quotidiennement par les cyanophages. Les cyanophages sont largement distribués à la fois dans la colonne d'eau et géographiquement. Des populations de cyanophages habitent des tapis microbiens dans l'Arctique grâce à des analyses métagénomiques et à des lagunes hypersalines. Ils peuvent supporter des températures allant de 12 à 30 °C et des salinités de 18 à 70 ppt. L'ADN des cyanophages est sensible à la dégradation par les UV mais peut être restauré dans les cellules hôtes grâce à un processus appelé « photoréactivation ». Les virus ne peuvent pas se déplacer indépendamment et doivent dépendre des courants, du mélange et des cellules hôtes pour les transporter. Les virus ne peuvent pas cibler activement leurs hôtes et doivent attendre pour les rencontrer. La probabilité plus élevée de collision peut expliquer pourquoi les cyanophages de la famille des Myoviridae infectent principalement l'une des cyanobactéries les plus abondantes, Synechoccocus . L'évidence d'une co-variation saisonnière entre les phages et les hôtes, en plus d'une augmentation des cyanophages au-dessus d'un seuil de 10 3 à 10 4 Synechococcus mL −1 , peut suggérer une dynamique « kill-the-winner ».
Impact biologique et physique
Les membres du genre Synechococcus contribuent à environ 25 % de la productivité primaire photosynthétique dans l'océan, ayant un effet ascendant significatif sur les niveaux trophiques supérieurs. La matière organique dissoute (MOD) libérée de la lyse virale par les cyanophages peut être dérivée dans la boucle microbienne où elle est recyclée ou rejetée par les bactéries hétérotrophes pour former une matière récalcitrante qui est finalement enfouie dans les sédiments. Il s'agit d'une étape importante dans la séquestration du carbone atmosphérique, communément appelée pompe biologique , et le maintien d'autres cycles biogéochimiques .
Les cyanobactéries effectuent une photosynthèse oxygénée qui serait à l'origine de l'oxygène atmosphérique il y a environ 2,5Ga. La population et, par conséquent, le taux d'évolution de l'oxygène peuvent être régulés par les cyanophages. Chez certaines espèces de cyanobactéries, telles que Trichodesmium qui effectuent la fixation de l'azote, les cyanophages sont capables d'augmenter le taux d'approvisionnement en azote organique biodisponible par lyse.
Les cyanophages infectent également les cyanobactéries formant des efflorescences qui peuvent être toxiques pour la santé des humains et d'autres animaux par la production de microcystine et provoquer une eutrophisation , conduisant à des zones de minimum d'oxygène . Les cyanophages peuvent infecter et tuer quatre cyanobactéries communes formant des efflorescences : Lyngbya birgei , Anabaena circinalis , Anabaena flosaquae et Microcystis aeruginosa , et peuvent ainsi prévenir les proliférations d'algues nuisibles dans des conditions normales. Les efflorescences causent des problèmes écologiques, économiques et dans les systèmes d'eau douce, nuisent à la qualité de l'eau potable. Les pics dans les populations de cyanobactéries sont généralement provoqués par des augmentations de nutriments dues au ruissellement des engrais, de la poussière et des eaux usées. En tuant les hôtes, les cyanophages peuvent aider à rétablir l'équilibre naturel des écosystèmes.
En plus de réguler la taille de la population, les cyanophages influencent probablement la composition phylogénétique en permettant à d'autres phytoplanctons normalement inhibés par les cyanobactéries de se développer. La spécificité avec laquelle les cyanophages ciblent divers hôtes affecte également la structure de la communauté. En raison de la phase lysogène de leur cycle de réplication, les cyanophages peuvent se comporter comme des éléments génétiques mobiles pour la diversification génétique de leurs hôtes par transfert horizontal de gènes . Que la phase lytique ou lysogène domine dans une zone donnée a été supposée dépendre des conditions eutrophes ou oligotrophes, respectivement. L'augmentation du nombre de rencontres est directement liée à une augmentation du taux d'infection offrant plus de possibilités de pression sélective, rendant les Synechococcus côtiers plus résistants à l'infection virale que leurs homologues du large.
Les références
Lectures complémentaires
- Clokie MR, Mann NH (décembre 2006). "Cyanophages marins et lumière" . Environ. Microbiole . 8 (12) : 2074-2082. doi : 10.1111/j.1462-2920.2006.01171.x . PMID 17107549 . Récupéré le 10 juillet 2020 .
- Mann NH (avril 2003). "Phages du picophytoplancton cyanobactérien marin" . FEMS Microbiol. Rév . 27 (1) : 17-34. doi : 10.1016/S0168-6445(03)00016-0 . PMID 12697340 .
- Paul JH, Sullivan MB (juin 2005). « Génomique des phages marins : qu'avons-nous appris ? ». Opinion actuelle en biotechnologie . 16 (3) : 299-307. doi : 10.1016/j.copbio.2005.03.007 . PMID 15961031 .
- Suttle, Californie (2000). "Chapitre 20: Cyanophages et leur rôle dans l'écologie des cyanobactéries". À Whitton, BA; Potts, M (éd.). L'écologie des cyanobactéries : leur diversité dans le temps et dans l'espace . Éditeurs académiques Kluwer. p. 563-589. ISBN 978-0-7923-4755-2.


