Dihydroxylation - Dihydroxylation
La dihydroxylation est le processus par lequel un alcène est converti en un diol vicinal . Bien qu'il existe de nombreuses voies pour réaliser cette oxydation , les procédés les plus courants et les plus directs utilisent un métal de transition à haut état d'oxydation (généralement l'osmium ou le manganèse). Le métal est souvent utilisé comme catalyseur , avec un autre oxydant stoechiométrique présent. De plus, d'autres métaux de transition et méthodes de métaux non-transitionnels ont été développés et utilisés pour catalyser la réaction.
Mécanisme
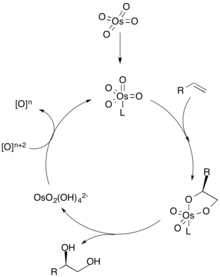
Dans le mécanisme de dihydroxylation, un ligand se coordonne d'abord avec le catalyseur métallique (représenté par l'osmium), qui dicte la sélectivité chirale de l'oléfine. L'alcène se coordonne ensuite avec le métal par une cycloaddition [3 + 2], et le ligand se dissocie du catalyseur métallique. L'hydrolyse de l'oléfine donne alors le diol vicinal, et l'oxydation du catalyseur par un oxydant stoechiométrique régénère le catalyseur métallique pour répéter le cycle. La concentration de l'oléfine est cruciale pour l'excès énantiomérique du diol car des concentrations plus élevées de l'alcène peuvent s'associer à l'autre site catalytique pour produire l'autre énantiomère.
Réactions catalysées par l'osmium
Le tétroxyde d'osmium (OsO 4 ) est un oxydant populaire utilisé dans la dihydroxylation d'alcènes en raison de sa fiabilité et de son efficacité dans la production de syn-diols. Puisqu'il est coûteux et toxique, des quantités catalytiques d'OsO 4 sont utilisées conjointement avec un agent oxydant stoechiométrique. Les réactions d' hydroxylation Milas , de dihydroxylation d'Upjohn et de dihydroxylation asymétrique Sharpless utilisent toutes de l'osmium comme catalyseur ainsi que divers agents oxydants secondaires.
Milas
La dihydroxylation Milas a été introduite en 1930 et utilise du peroxyde d'hydrogène comme agent oxydant stoechiométrique. Bien que le procédé puisse produire des diols, une suroxydation en composé dicarbonyle a conduit à des difficultés d'isolement du diol vicinal. Par conséquent, le protocole Milas a été remplacé par la dihydroxylation asymétrique Upjohn et Sharpless.
Upjohn
La dihydroxylation d'Upjohn a été rapportée en 1973 et utilise OsO 4 comme catalyseur actif dans la procédure de dihydroxylation. Il utilise également du N-oxyde de N-méthylmorpholine (NMO) comme oxydant stoechiométrique pour régénérer le catalyseur à l'osmium, ce qui permet d'utiliser des quantités catalytiques d'osmium. Le protocole Upjohn donne des conversions élevées en diol vicinal et tolère de nombreux substrats. Cependant, le protocole ne peut pas dihydroxyler les alcènes tétrasubstitués. Les conditions d'Upjohn peuvent être utilisées pour synthétiser des anti-diols à partir d'alcools allyliques, comme l'ont démontré Kishi et ses collègues.
Asymétrique Sharpless
La dihydroxylation asymétrique Sharpless a été développée par K. Barry Sharpless pour utiliser des quantités catalytiques d'OsO 4 avec l'oxydant stoechiométrique K 3 [Fe (CN) 6 ]. La réaction est effectuée en présence d'un auxiliaire chiral. La sélection de la dihydroquinidine (DHQD) ou de la dihydroquinine (DHQ) comme auxiliaire chiral dicte la sélectivité faciale de l'oléfine, car la configuration absolue des ligands est opposée. Le catalyseur, l'oxydant et l'auxiliaire chiral peuvent être achetés prémélangés pour une dihydroxylation sélective. AD-mix-α contient l'auxiliaire chiral (DHQ) 2 PHAL, qui positionne OsO 4 sur la face alpha de l'oléfine; AD-mix-β contient (DHQD) 2 PHAL et délivre des groupes hydroxyle à la face bêta. La dihydroxylation asymétrique Sharpless a une large portée pour la sélectivité du substrat en changeant la classe auxiliaire chirale.
Autres variantes
Comme mentionné ci-dessus, l'aptitude à synthétiser des anti-diols à partir d'alcools allyliques peut être obtenue avec l'utilisation de NMO comme oxydant stoechiométrique. L'utilisation de la tétraméthylènediamine (TMEDA) comme ligand a produit des syn-diols avec un rapport diastéréoisomérique favorable par rapport au protocole de Kishi; cependant, de l'osmium stoechiométrique est utilisé. La sélectivité syn est due à la capacité de donneur de liaison hydrogène de l'alcool allylique et à la capacité d'acceptation de la diamine. Cela a depuis été appliqué aux systèmes homoallyliques.
Autres méthodes de dihydroxylation
Etant donné que le tétroxyde d'osmium est coûteux et toxique, d'autres métaux ont été utilisés pour préparer des diols vicinaux à partir d'oléfines. Un autre métal populaire utilisé dans la dihydroxylation est le ruthénium. Bien qu'il soit hautement oxydant, le ruthénium a été utilisé en raison de son temps de réaction court et de sa rentabilité. Typiquement, le tétroxyde de ruthénium est créé in situ à partir de trichlorure de ruthénium, et un oxydant secondaire NaIO 4 est utilisé pour régénérer le catalyseur. L'étape limitant le renouvellement de la réaction est l'étape d'hydrolyse; par conséquent, de l'acide sulfurique est ajouté pour augmenter la vitesse de cette étape.
Le manganèse est également utilisé dans la dihydroxylation et est souvent choisi lorsque les méthodes au tétroxyde d'osmium donnent de mauvais résultats. Semblable au ruthénium, le potentiel d'oxydation du manganèse est élevé, conduisant à une sur-oxydation des substrats. Le permanganate de potassium est souvent utilisé comme oxydant pour la dihydroxylation; cependant, en raison de sa faible solubilité dans un solvant organique, un catalyseur de transfert de phase (tel que le chlorure de benzyltriéthylammonium, TEBACl) est également ajouté pour augmenter le nombre de substrats pour la dihydroxylation.
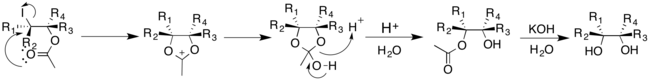
Dihydroxylation de Prévost et Woodward
Contrairement aux autres méthodes décrites qui utilisent des métaux de transition comme catalyseur, les méthodes Prévost et Woodward utilisent de l'iode et un sel d'argent. Cependant, l'addition d'eau dans la réaction dirige l'addition cis et trans des groupes hydroxyle. La réaction de Prévost utilise typiquement du benzoate d'argent pour produire des trans-diols; la modification Woodward de la réaction de Prévost utilise de l'acétate d'argent pour produire des cis-diols. Dans les réactions de Prévost et de Woodward, de l'iode est d'abord ajouté à l'alcène, produisant un ion iodinium cyclique. L'anion du sel d'argent correspondant est ensuite ajouté par substitution nucléophile à l'ion iodinium.
Dans la réaction de Prévost, l'ion iodinium subit une attaque nucléophile par l'anion benzoate. L'anion benzoate agit à nouveau comme un nucléophile pour déplacer l'iodure à travers un mécanisme de participation de groupe voisin. Un deuxième anion benzoate réagit avec l'intermédiaire pour produire le produit de dibenzoate anti-substitué, qui peut ensuite subir une hydrolyse pour donner des trans-diols.
La modification Woodward de la réaction de Prévost donne des cis-diols. L'anion acétate réagit avec l'ion iodinium cyclique pour donner un ion oxonium intermédiaire. Celui-ci peut alors facilement réagir avec l'eau pour donner le monoacétate, qui peut ensuite être hydrolysé pour donner un cis-diol
Pour éliminer le besoin de sels d'argent, Sudalai et ses collègues ont modifié la réaction Prévost-Woodward; la réaction est catalysée avec LiBr et utilise NaIO 4 et PhI (OAc) 2 comme oxydants. LiBr réagit avec NaIO 4 et l'acide acétique pour produire de l'acétate de lithium, qui peut ensuite passer par la réaction comme mentionné précédemment. Le protocole a produit un dr élevé pour le diol correspondant, en fonction de l'oxydant choisi.
Applications
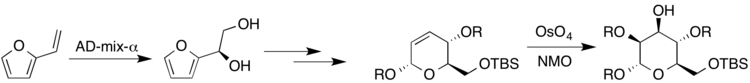
La synthèse de sucres hautement substitués et stéréospécifiques est importante car les polysaccharides constituent une grande classe de composés trouvés dans la nature. Un exemple spécifique est dans la molécule biologiquement active kakelokelose, qui s'est avérée avoir une activité anti-VIH. Les recherches menées par Harris et al. ont travaillé sur une synthèse énantiospécifique de sucres appartenant au kakelokelose et à d'autres sucres, en employant de nombreuses réactions de dihydroxylation différentes avec un catalyseur à l'osmium. Le vinylfurane a été mis à réagir dans des conditions Sharpless avec AD-mix-a pour donner du (R) -diol. Plus tard, un dihydropyrane résultant a été mis à réagir dans les conditions d'Upjohn pour donner le sucre résultant, le mannose (où R représente soit H soit un groupe protecteur).
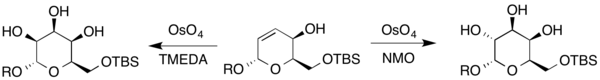
De plus, le talose et la gulose ont également été synthétisés à partir d'un dihydropyrane différent. Puisque le composé contient un alcool allylique, Upjohn conditionne et la modification Upjohn en utilisant TMEDA comme oxydant secondaire pour créer les sucres résultants (où R représente H ou un groupe protecteur).
Une autre application des méthodes de dihydroxylation est la synthèse de stéroïdes. Les brassinostéroïdes sont une classe de stéroïdes qui régulent la croissance des plantes et qui ont une activité agricole en tant qu'insecticide. Cette classe de stéroïdes contient le cadre standard des stéroïdes en plus de quatre diols vicinaux qui ont leur propre stéréochimie. Brosa a installé les groupes hydroxyle dans le stéroïde en utilisant les deux conditions de Woodward pour donner un cis-diol à l'anneau A du stéroïde. Ensuite, la chaîne alcène sur le cycle D a été dihydroxylé pour donner le deuxième cis-diol en utilisant OsO 4 et NMO comme oxydant stoechiométrique.