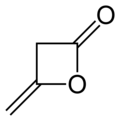
Dicétène - Diketene
|
|
|||
| Des noms | |||
|---|---|---|---|
|
Nom IUPAC préféré
4-méthylidèneoxétan-2-one |
|||
| Autres noms
γ-méthylènepropiolactone
|
|||
| Identifiants | |||
|
Modèle 3D ( JSmol )
|
|||
| ChemSpider | |||
| Carte Info ECHA |
100.010.562 |
||
| Numéro CE | |||
|
PubChem CID
|
|||
| Numéro RTECS | |||
| UNII | |||
| Numéro UN | 2521 | ||
|
Tableau de bord CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriétés | |||
| C 4 H 4 O 2 | |||
| Masse molaire | 84,074 g · mol −1 | ||
| Densité | 1,09 g cm −3 | ||
| Point de fusion | −7 ° C (19 ° F; 266 K) | ||
| Point d'ébullition | 127 ° C (261 ° F; 400 K) | ||
| Viscosité | 0,88 mPa.s | ||
| Dangers | |||
| Pictogrammes SGH |
   
|
||
| Mot de signalisation SGH | Danger | ||
| H226 , H301 , H302 , H315 , H318 , H330 , H331 , H332 , H335 | |||
| P210 , P233 , P240 , P241 , P242 , P243 , P260 , P261 , P264 , P270 , P271 , P280 , P284 , P301 + 310 , P301 + 312 , P302 + 352 , P303 + 361 + 353 , P304 + 312 , P304 + 340 , P305 + 351 + 338 , P310 , P311 , P312 , P320 , P321 | |||
| point de rupture | 33 ° C (91 ° F; 306 K) | ||
| 275 | |||
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Références Infobox | |||
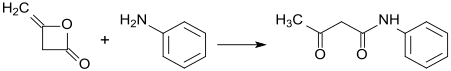
Le dicétène est un composé organique de formule moléculaire C 4 H 4 O 2 , et qui s'écrit parfois (CH 2 CO) 2 . Il est formé par dimérisation du cétène , H 2 C = C = O. Le dicétène fait partie de la famille des oxétanes . Il est utilisé comme réactif en chimie organique . C'est un liquide incolore.
Production
Le cétène est généré par déshydratation de l'acide acétique à 700–750 ° C en présence de phosphate de triéthyle comme catalyseur ou par thermolyse de l' acétone à 600–700 ° C en présence de disulfure de carbone comme catalyseur.
La dimérisation en dicétène se déroule spontanément à température ambiante:
- 2 H 2 C = C = O → C 4 H 4 O 2
Réactions
Le chauffage ou l'irradiation avec de la lumière UV régénère le monomère cétène:
- (C 2 H 2 O) 2 ⇌ 2 CH 2 CO
Les cétènes alkylés se dimérisent également facilement et forment des dicétènes substitués.
Le dicétène s'hydrolyse facilement dans l'eau pour former de l' acide acétoacétique . Sa demi-vie dans l'eau est d'environ 45 min. a 25 ° C à 2 < pH <7.
Certains dicétènes à deux chaînes aliphatiques , tels que les dimères d' alkylcétène (AKD), sont utilisés industriellement pour améliorer l' hydrophobicité du papier .
À un moment donné, l'anhydride acétique a été préparé par la réaction du cétène avec de l'acide acétique:
- H 2 C = C = O + CH 3 COOH → (CH 3 CO) 2 O Δ H = −63 kJ mol −1
Acétoacétylation
Le dicétène réagit également avec les alcools et les amines aux dérivés d'acide acétoacétique correspondants. Le processus est parfois appelé acétoacétylation. Un exemple est la réaction avec le 2-aminoindane :
Le dicétène est un intermédiaire industriel important utilisé pour la production d'esters et d'amides d'acétoacétate ainsi que de 1-phényl-3-méthylpyrazolones substituées. Ces derniers sont utilisés dans la fabrication de colorants et de pigments. Une réaction typique est:
- ArNH 2 + (CH 2 CO) 2 → ArNHC (O) CH 2 C (O) CH 3
Ces acétoacétamides sont des précurseurs des pigments jaune arylide et diarylide .
Utiliser
Les dicétènes à deux chaînes alkyles sont utilisés dans la fabrication de papier d' encollage de papier afin d'améliorer leur imprimabilité (par hydrophobisation ). Outre les résines colophanes représentant environ 60% de la consommation mondiale, les dicétènes à longue chaîne appelés dimères d'alkylcétène (AKD) sont avec 16% des papiers synthétiques les plus importants, ils sont généralement utilisés à des concentrations de 0,15%, soit 1,5 kg d'AKD solide / t papier.
La préparation d'AKD est réalisée par chloration d'acides gras à longue chaîne (tels que l'acide stéarique , en utilisant des agents de chloration tels que le chlorure de thionyle ) pour donner les chlorures d'acide correspondants et l'élimination ultérieure de HCl par des amines (par exemple la triéthylamine ) dans du toluène ou autre. solvants:
En outre, les dicétènes sont utilisés comme intermédiaires dans la fabrication de produits pharmaceutiques , d' insecticides et de colorants . Par exemple, les pyrazolones sont formées à partir de phénylhydrazines substituées , elles étaient utilisées comme analgésiques mais sont aujourd'hui largement obsolètes. Avec la méthylamine, les dicétènes réagissent au N , N ' -diméthylacétoacétamide qui est chloré avec du chlorure de sulfuryle et réagit avec le triméthylphosphite à l'insecticide monocrotophos hautement toxique (particulièrement toxique pour les abeilles). Les dicétènes réagissent avec les amines aromatiques substituées aux acétoacétanilides , qui sont des précurseurs importants pour les colorants azoïques et les pigments azoïques principalement jaunes, oranges ou rouges .
Un exemple de synthèse d'arylures par réaction de dicétènes avec des amines aromatiques est:
Couplage du diazonium aromatique avec des arylides pour former des colorants azoïques, tels que le Pigment Yellow 74 :
La synthèse industrielle de l'édulcorant acésulfam-K est basée sur la réaction du dicétène avec l'acide sulfamique et la cyclisation par le trioxyde de soufre (SO 3 ).
Sécurité
Malgré sa forte réactivité en tant qu'agent alkylant , et contrairement aux analogues β-lactones propiolactone et β-butyrolactone, le dicétène est inactif en tant qu'agent cancérigène, probablement en raison de l'instabilité de ses adduits à l'ADN .

![{\ displaystyle {\ begin {array} {lclrr} \\ {\ ce {CH3CO2H}} & {\ ce {-> [{\ overset {\ text {triethyl phosphate}} {\ ce {(CH3CH2O) 3PO}} }] [{\ text {700–750 ° C}}]}} & {\ ce {{\ underset {cétène} {H2C = C = O}} + H2O}} && \ Delta H = + 147 {\ text {kJ mol}} ^ {- 1} \\ {} \\ {\ ce {CH3COCH3}} & {\ ce {-> [{\ overset {\ text {carbon disulfide}} {\ ce {CS2}}} ] [{\ text {600–700 ° C}}]}} & {\ ce {{H2C = C = O} + CH4}} \\ {} \ end {array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5e895574e8077850caecc78d024f20ebd56c1e1e)