Diphosphore - Diphosphorus
|
|
|||
| Des noms | |||
|---|---|---|---|
|
Nom IUPAC
Diphosphore
|
|||
|
Nom IUPAC systématique
Diphosphyne |
|||
| Identifiants | |||
|
Modèle 3D ( JSmol )
|
|||
| ChEBI | |||
| ChemSpider | |||
| 1400241 | |||
|
PubChem CID
|
|||
|
|||
|
|||
| Propriétés | |||
| P 2 | |||
| Masse molaire | 61,947 523 996 g · mol −1 | ||
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Références Infobox | |||
Le diphosphore est un produit chimique inorganique de formule chimique P
2. Contrairement à l'azote, son voisin pnictogène plus léger qui forme une molécule N 2 stable avec une triple liaison azote-azote , le phosphore préfère une forme tétraédrique P 4 parce que les liaisons pi PP sont riches en énergie. Le diphosphore est donc très réactif avec une énergie de dissociation des liaisons (117 kcal / mol ou 490 kJ / mol) égale à la moitié de celle du diazote . La distance de liaison a été mesurée à 1,8934 Å.
Synthèse
Le diphosphore a été produit en chauffant du phosphore blanc à 1 100 kelvins (827 ° C ). Néanmoins, certains progrès ont été obtenus dans la génération de la molécule diatomique en solution homogène dans des conditions normales avec l'utilisation de certains complexes de métaux de transition (à base, par exemple, de tungstène et de niobium ). Des méthodes de dissociation des liaisons dans les molécules P 4 par photoexcitation ont également été proposées.
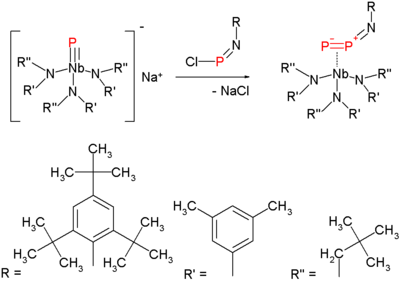
La molécule a attiré l'attention en 2006, lorsqu'une nouvelle méthode pour sa synthèse à des températures plus douces est apparue. Cette méthode est une variante de l'expulsion d'azote dans les azotures avec formation d'un nitrène . La synthèse du précurseur diphosphore consiste à faire réagir un phosphure de niobium terminal avec un chloroiminophosphane:
Le chauffage de ce composé à 50 ° C dans du 1,3-cyclohexadiène servant de solvant et de réactif de piégeage expulse le diphosphore, qui est réactif, car les produits finaux sont un double adduit Diels – Alder et le composé niobium imido:
Le même composé imido se forme également lorsque la thermolyse est effectuée dans le toluène , mais dans ce cas le sort du diphosphore est inconnu.
Il a été suggéré que le P 2 se forme comme intermédiaire dans la photolyse du P 4 , et en présence de 2,3-diméthyl-1,3-butadiène, le diphosphane résultant de l'addition de Diels-Alder est à nouveau formé. À ce jour, aucune preuve directe de formation de P 2 via la photolyse de P 4 n'existe.
La génération de diphosphore à partir d'un adduit diphosphore-bisanthracène a été signalée. La synthèse d'un cation HP 2 + stabilisé a été rapportée.
Les références
Liens externes
- Ron Dagani, "A Mild Route to P2", Chemical & Engineering News 4 septembre 2006 Lien
- Carmen Drahl "Flash Of Phosphorus Chemistry Innovation", Nouvelles de la chimie et de l'ingénierie 13 septembre 2010 Lien