Liaison glycosidique - Glycosidic bond
Une liaison glycosidique ou liaison glycosidique est un type de liaison covalente qui relie une molécule d' hydrate de carbone (sucre) à un autre groupe, qui peut être ou non un autre glucide.
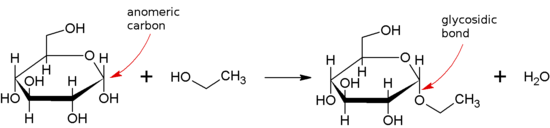
Une liaison glycosidique se forme entre le groupe hémiacétal ou hémicétal d'un saccharide (ou une molécule dérivée d'un saccharide) et le groupe hydroxyle d'un composé tel qu'un alcool . Une substance contenant une liaison glycosidique est un glycoside .
Le terme "glycoside" est maintenant étendu pour couvrir également les composés avec des liaisons formées entre les groupes hémiacétal (ou hémicétal) des sucres et plusieurs groupes chimiques autres que les hydroxyles, tels que -SR (thioglycosides), -SeR (sélénoglycosides), -NR 1 R 2 (N-glycosides), voire -CR 1 R 2 R 3 (C-glycosides).
En particulier dans les glycosides d'origine naturelle, le composé ROH dont le résidu d'hydrate de carbone a été éliminé est souvent appelé aglycone, et le résidu d'hydrate de carbone lui-même est parfois appelé "glycone".
Liaisons S-, N-, C- et O-glycosidiques

Les liaisons glycosidiques de la forme décrite ci-dessus sont connues sous le nom de liaisons O-glycosidiques , en référence à l' oxygène glycosidique qui lie le glycoside à l'aglycone ou au sucre final réducteur. Par analogie, on considère également les liaisons S-glycosidiques (qui forment des thioglycosides ), où l'oxygène de la liaison glycosidique est remplacé par un atome de soufre . De la même manière, les liaisons N-glycosidiques ont la liaison glycosidique oxygène remplacée par de l' azote . Les substances contenant des liaisons N-glycosidiques sont également appelées glycosylamines . Les liaisons C-glycosyle ont l'oxygène glycosidique remplacé par un carbone ; le terme "C-glycoside" est considéré comme un abus de langage par l' IUPAC et est déconseillé. Toutes ces liaisons glycosidiques modifiées ont une sensibilité différente à l'hydrolyse, et dans le cas des structures C-glycosylées, elles sont généralement plus résistantes à l'hydrolyse.
Numérotation et distinction α/β des liaisons glycosidiques
Lorsqu'un centre anomère est impliqué dans une liaison glycosidique (comme cela est courant dans la nature), on peut alors distinguer les liaisons α- et -glycosidiques par la stéréochimie relative de la position anomère et du stéréocentre le plus éloigné de C1 dans le saccharide.
Les pharmacologues associent souvent des substances à l'acide glucuronique via des liaisons glycosidiques afin d'augmenter leur solubilité dans l' eau ; c'est ce qu'on appelle la glucuronidation . De nombreux autres glycosides ont des fonctions physiologiques importantes.
Approches chimiques
Nüchter et al. (2001) ont montré une nouvelle approche de la glycosidation de Fischer . Utilisant un four à micro- ondes équipé d'un appareil de reflux dans un réacteur à rotor avec des bombes à pression , Nüchter et al. (2001) ont pu atteindre un rendement de 100 % en - et β-D-glucosides. Cette méthode peut être effectuée sur une échelle de plusieurs kilogrammes.
- La méthode de Vishal Y Joshi
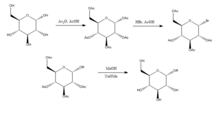
Joshi et al. (2006) proposent la méthode de Koenigs-Knorr dans la synthèse stéréosélective d'alkyl D-glucopyranosides par glycosylation, à l'exception de l'utilisation du carbonate de lithium qui est moins coûteuse et toxique que la méthode conventionnelle d'utilisation de sels d' argent ou de mercure . Le D-glucose est d'abord protégé en formant le peracétate par addition d' anhydride acétique dans l'acide acétique , puis addition de bromure d'hydrogène qui brome en position 5. Lors de l'ajout de l'alcool ROH et du carbonate de lithium, l'OR remplace le brome et lors de la déprotection des hydroxyles acétylés, le produit est synthétisé avec une pureté relativement élevée. Il a été suggéré par Joshi et al. (2001) que le lithium agit comme le nucléophile qui attaque le carbone en position 5 et à travers un état de transition, l'alcool se substitue au groupe brome. Les avantages de cette méthode ainsi que sa stéréosélectivité et le faible coût du sel de lithium incluent qu'elle peut être effectuée à température ambiante et son rendement se compare relativement bien avec la méthode conventionnelle de Koenigs-Knorr.
Glycoside hydrolases
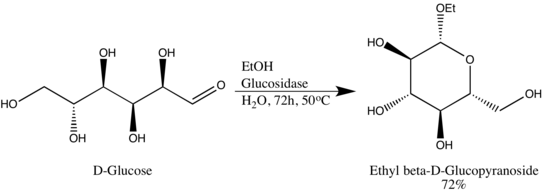
Les glycoside hydrolases (ou glycosidases) sont des enzymes qui rompent les liaisons glycosidiques. Les glycoside hydrolases peuvent typiquement agir sur les liaisons α- ou β-glycosidiques, mais pas sur les deux. Cette spécificité permet aux chercheurs d'obtenir des glycosides en excès épimère élevé, un exemple étant la conversion par Wen-Ya Lu du D-Glucose en Ethyl β-D-glucopyranoside en utilisant une glucosidase d'origine naturelle. Il convient de noter que Wen-Ya Lu a utilisé la glucosidase de manière inverse à la fonctionnalité biologique de l'enzyme :
Glycosyltransférases
Avant que les unités monosaccharidiques ne soient incorporées dans les glycoprotéines, les polysaccharides ou les lipides des organismes vivants, elles sont généralement d'abord "activées" en étant liées par une liaison glycosidique au groupe phosphate d'un nucléotide tel que l' uridine diphosphate (UDP), la guanosine diphosphate (GDP) , thymidine diphosphate (TDP) ou cytidine monophosphate (CMP). Ces intermédiaires biochimiques activés sont appelés nucléotides de sucre ou donneurs de sucre. De nombreuses voies de biosynthèse utilisent des mono- ou oligosaccharides activés par une liaison diphosphate aux lipides, tels que le dolichol . Ces donneurs activés sont alors des substrats pour des enzymes connues sous le nom de glycosyltransférases , qui transfèrent l'unité sucre du donneur activé à un nucléophile accepteur (le substrat accepteur).
Disaccharide phosphorylase
Différentes approches biocatalytiques ont été développées pour la synthèse de glycosides au cours des dernières décennies, qui utilisant des « glycosyltransférases » et des « glycoside hydrolases » sont parmi les catalyses les plus courantes. Le premier a souvent besoin de matériaux coûteux et le dernier montre souvent de faibles rendements, De Winter et al. ont étudié l'utilisation de la cellobiose phosphorylase (CP) pour la synthèse des alpha-glycosides dans les liquides ioniques. La meilleure condition d'utilisation du CP s'est avérée être la présence d'IL AMMOENG 101 et d'acétate d'éthyle.
Glycosylations dirigées
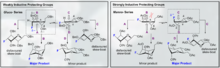
De multiples approches chimiques existent pour encourager la sélectivité des liaisons - et -glycosidiques. La nature hautement spécifique du substrat de la sélectivité et l'activité globale du pyranoside peuvent fournir des difficultés de synthèse majeures. La spécificité globale de la glycosylation peut être améliorée en utilisant des approches qui prennent en compte les états de transition relatifs que le carbone anomérique peut subir au cours d'une glycosylation typique. Plus particulièrement, la reconnaissance et l'incorporation des modèles de Felkin-Ahn-Eisenstein dans la conception chimique rationnelle peuvent généralement fournir des résultats fiables à condition que la transformation puisse subir ce type de contrôle conformationnel dans l'état de transition.
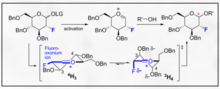
Les glycosylations dirigées par le fluor représentent une poignée encourageante à la fois pour la sélectivité B et l'introduction d'une fonctionnalité C2 biomimétique non naturelle sur le glucide. Un exemple innovant fourni par Bucher et al. fournit un moyen d'utiliser un ion fluoro oxonium et le trichloroacétimidate pour encourager la stéréosélectivité B par l'effet gauche. Cette stéréosélectivité raisonnable est claire grâce à la visualisation des modèles de Felkin-Ahn des formes de chaise possibles.
Cette méthode représente un moyen encourageant d'incorporer de la sélectivité du B-éthyle, de l'isopropyle et d'autres glycosides avec la chimie typique du trichloroacétimidate.
glycopeptides liés en O ; utilisations pharmaceutiques des peptides O-glycosylés
Il a récemment été démontré que les glycopeptides liés à l'O présentent une excellente perméabilité et efficacité du SNC dans plusieurs modèles animaux présentant des états pathologiques. De plus, l'un de ses aspects les plus intrigants est la capacité de la O-glycosylation à prolonger la demi-vie, à diminuer la clairance et à améliorer la PK/PD de ce peptide actif au-delà de l'augmentation de la pénétration du SNC. L'utilisation innée des sucres en tant que fractions solubilisantes dans le métabolisme des phases II et III (acides glucuroniques) a remarquablement permis un avantage évolutif en ce que les enzymes des mammifères ne sont pas directement évoluées pour dégrader les produits O glycosylés sur des fractions plus grandes.
La nature particulière des glycopeptides liés par O est qu'il existe de nombreux exemples qui sont pénétrants du SNC. On pense que la base fondamentale de cet effet implique le « saut de membrane » ou la « diffusion du houblon ». On pense que le processus de "diffusion du houblon" entraîné par un mouvement non brownien se produit en raison de la discontinuité de la membrane plasmique. La « diffusion du houblon » combine notamment diffusion libre et transitions intercomparmentales. Des exemples récents incluent notamment la haute perméabilité des analogues de la met-enképhaline parmi d'autres peptides. Le pentapeptide agoniste mOR complet DAMGO est également pénétrant dans le SNC lors de l'introduction de la glycosylation.
Les références
- Marco Brito-Arias, "Synthesis and Characterization of Glycosides", deuxième édition, Editorial Springer 2016.
Liens externes
- Définition des glycosides , extraite du Compendium de terminologie chimique de l' IUPAC , le " Livre d'or "
- Varki A et al. L'essentiel de la glycobiologie. Presse de laboratoire Cold Spring Harbor ; 1999. Recherche en ligne