Higénamine - Higenamine

|
|
| Noms | |
|---|---|
|
Nom IUPAC
1 - [(4-hydroxyphényl) méthyl] -1,2,3,4-tétrahydroisoquinoléine-6,7-diol
|
|
| Autres noms
norcoclaurine, déméthylcoclaurine
|
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| KEGG | |
| Engrener | higénamine |
|
PubChem CID
|
|
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 16 H 17 N O 3 | |
| Masse molaire | 271,316 g · mol −1 |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Références Infobox | |
L'higénamine ( norcoclaurine ) est un composé chimique présent dans une variété de plantes, notamment Nandina domestica (fruit), Aconitum carmichaelii (racine), Asarum heterotropioides , Galium divaricatum (tige et vigne), Annona squamosa et Nelumbo nucifera (graines de lotus).
L'higénamine est présente comme ingrédient dans les compléments alimentaires pour le sport et la perte de poids vendus aux États-Unis. La Food and Drug Administration des États-Unis a reçu des rapports d'effets indésirables des suppléments contenant de l'higénamine depuis 2014, mais les risques pour la santé de l'higénamine restent mal compris.
Légalité
L'higénamine, également connue sous le nom de chlorhydrate de norcoclaurine , est légale à utiliser dans les compléments alimentaires au Royaume - Uni , dans l' UE , aux États - Unis et au Canada . Son utilisation principale se situe dans les compléments alimentaires développés pour la gestion du poids et les compléments sportifs. Les formulations traditionnelles à base d'higénamine sont utilisées depuis des milliers d'années dans la médecine chinoise et proviennent de diverses sources, notamment des fruits et des orchidées. Il n'existe aucune étude comparant la sécurité des formulations modernes (à base d'higénamine synthétique) avec les formulations traditionnelles. Néanmoins, il ne sera pas ajouté au catalogue des «nouveaux aliments» de l'UE, qui détaille tous les compléments alimentaires qui nécessitent un certificat d'évaluation de la sécurité avant utilisation.
Avec de nombreux autres agonistes β 2 , l'utilisation de l'higénamine dans le sport est interdite par l'Agence mondiale antidopage . En 2016, le footballeur français Mamadou Sakho a été temporairement banni par l'UEFA après avoir été testé positif pour Higenamine, ce qui a amené le joueur à manquer la finale de la Ligue Europa 2016. L'interdiction a été levée après que le joueur ait réussi à faire valoir la défense atténuante selon laquelle il y avait une absence de négligence significative car la substance ne figurait pas sur la liste des substances interdites malgré l'interdiction des médicaments de la même catégorie - les β 2 agonistes.
Pharmacologie
Étant donné que l'higénamine est présente dans les plantes qui ont des antécédents d'utilisation en médecine traditionnelle , la pharmacologie de ce composé a suscité un intérêt scientifique.
Dans les modèles animaux, il a été démontré que l'higénamine est un agoniste des récepteurs adrénergiques β 2 . Les récepteurs adrénergiques, ou récepteurs adrénergiques, appartiennent à la classe des récepteurs couplés aux protéines G et sont les récepteurs les plus importants de la membrane adipeuse , en plus d'être également exprimés dans le tissu musculaire squelettique. Ces récepteurs de la membrane adipeuse sont classés comme récepteurs adrénergiques α ou β. Bien que ces adrénorécepteurs partagent le même messager, l' adénosine monophosphate cyclique (AMPc), la voie de transduction spécifique dépend du type de récepteur (α ou β). L'higénamine exerce en partie ses actions par l'activation d'une enzyme, l' adénylate cyclase , responsable de l'augmentation des concentrations cellulaires du second messager adrénergique, l'AMPc.
Dans un modèle de rongeur, il a été constaté que l'higénamine produisait des effets cardiotoniques , de relaxation vasculaire et de bronchodilatateur . En particulier, l'higénamine, via un mécanisme de récepteurs bêta-adrénergiques, a induit une relaxation dans le corps caverneux du rat , conduisant à une amélioration de la vasodilatation et de la fonction érectile.
Liée à des signaux vasodilatateurs améliorés, il a été démontré que l'higénamine dans des modèles animaux possède une activité antiplaquettaire et antithrombotique via une voie dépendante de l'AMPc, suggérant que l'higénamine peut contribuer à une vasodilatation et une intégrité artérielle améliorées.
Chez l'homme, l'higénamine a été étudiée en tant que médicament expérimental en Chine pour une utilisation comme agent pharmacologique pour les tests de stress cardiaque ainsi que pour le traitement d'un certain nombre d'affections cardiaques, y compris les bradyarythmies. Les essais sur l'homme étaient relativement petits (allant de 10 à 120 sujets) et l'higénamine était administrée par voie intraveineuse, le plus souvent en utilisant des perfusions graduelles de 2,5 ou 5 mg. L'higénamine augmentait systématiquement la fréquence cardiaque mais avait des effets variables sur la pression artérielle. Une petite étude a décrit l'effet de l'higénamine sur le débit cardiaque: l'higénamine a entraîné une augmentation de la fraction d'éjection chez 15 patients atteints de maladie cardiaque.
Toxicité
La sécurité de l'higénamine administrée par voie orale chez l'homme est inconnue. Au cours d'une étude de toxicité aiguë, des souris ont reçu par voie orale le composé à une dose de 2 g par kg de poids corporel. Aucune souris n'est morte pendant l'étude. Dans les essais humains sur l'higénamine intraveineuse, les sujets ayant reçu de l'higénamine ont signalé un essoufflement, une accélération cardiaque, des étourdissements, des maux de tête, une oppression thoracique.
Biosynthèse
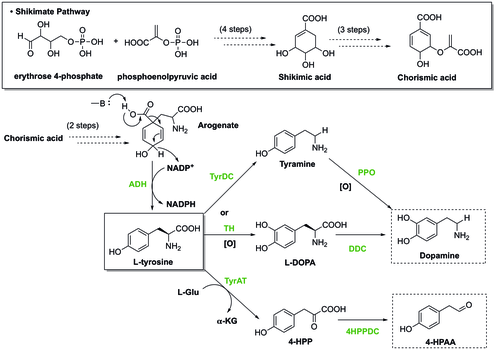
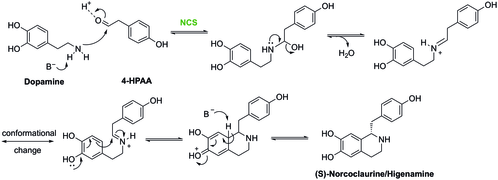
La (S) -Norcoclaurine / Higénamine est au centre de la biosynthèse des alcaloïdes benzylisoquinoléines (BIA). Malgré une grande diversité de structure, la biosynthèse des BIA partage tous un premier intermédiaire engagé (S) -norcoclaurine commun. La (S) -norcoclaurine est produite par la condensation de deux dérivés de la tyrosine, la dopamine et le 4-hydroxyphénylacétaldéhyde (4-HPAA).
Chez les plantes, la tyrosine est synthétisée par la voie Shikimate , au cours de laquelle la dernière étape implique la décarboxylation et la déshydrogénation de l'arogénate pour donner la L-tyrosine . Pour générer de la dopamine à partir de la tyrosine, il existe deux voies. Dans une voie, la tyrosine subit une décarboxylation catalysée par la tyrosine décarboxylase (TyrDC) pour devenir la tyramine, qui est ensuite suivie par l'oxydation de la polyphénol oxydase (PPO) pour rendre la dopamine. En variante, la tyrosine peut être oxydée par la tyrosine hydroxylase (TH) pour former la L-DOPA , qui est ensuite décarboxylée par la DOPA décarboxylase (DDC) pour fournir la dopamine. En outre, l'autre matériau de départ, le 4-HPAA, est généré par une première transamination par la tyrosine transeaminase (TyrAT) pour former le 4-hydroxylphénylpyruvate (4-HPP), et une décarboxylation ultérieure par la 4-HPP décarboxylase.
La condensation de la dopamine et de la 4-HPAA pour former la (S) -norcoclaurine est catalysée par la (S) -norcoclaurine synthase (NCS). Une telle réaction est un type de réaction de Pictet-Spengler . Dans cette réaction, Asp-141 et Glu-110 dans le site actif NCS sont impliqués dans l'activation de l'amine et du carbonyle respectivement pour faciliter la formation d'imine. Ensuite, la molécule sera cyclisée selon le mécanisme indiqué ci-dessous pour produire la (S) -nococlaurine.