Réarrangement de Kornblum – DeLaMare - Kornblum–DeLaMare rearrangement
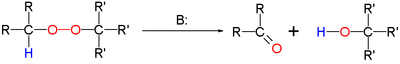
Le réarrangement Kornblum – DeLaMare est une réaction de réarrangement en chimie organique dans laquelle un peroxyde organique primaire ou secondaire est converti en la cétone et l'alcool correspondants sous catalyse acide ou basique . La réaction est pertinente en tant qu'outil de synthèse organique et constitue une étape clé dans la biosynthèse des prostaglandines .
La base peut être un hydroxyde tel que l'hydroxyde de potassium ou une amine telle que la triéthylamine .
Mécanisme de réaction
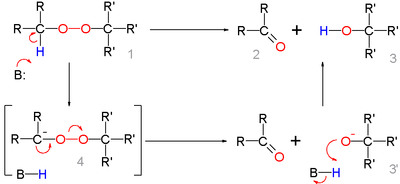
Dans le mécanisme de réaction pour cette réaction organique, la base extrait le proton α acide du peroxyde 1 pour former le carbanion 4 comme intermédiaire réactif qui se réarrange en cétone 2 avec expulsion de l'anion hydroxyle 3 ' . Cet intermédiaire gagne un proton formant l'alcool 3 .
La déprotonation et le réarrangement peuvent également être une réaction concertée sans formation de 4 .
Un mécanisme de réaction alternatif impliquant un déplacement nucléophile direct sur la liaison peroxyde de l'amine suivi d'une réaction d'élimination est considéré comme improbable sur la base du résultat de cette réaction modèle:
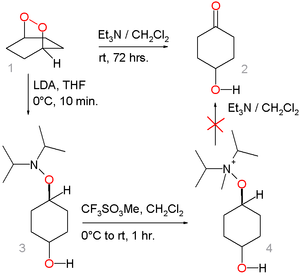
Le peroxyde 1 se transforme en hydroxycétone 2 par action de la triéthylamine mais la voie alternative à travers l' hydroxylamine 3 par déplacement nucléophile avec le diisopropylamide de lithium et le sel d'ammonium 4 (par méthylation avec le trifluorométhanesulfonate de méthyle ) échoue.
La réaction, formellement un réarrangement, se classe sous les réactions d'élimination comme déjà observé par les auteurs originaux. Non seulement les alcoxydes, mais tout groupe partant capable de porter une charge négative fera par exemple des esters de nitrate R – C (R) (H) –O – NO 2 .
Réactions liées
La réaction correspondante impliquant un éther est le réarrangement 1,2-Wittig . Le déroulement de la réaction dans ce réarrangement est différent car le clivage par l'éther avec formation de carbanions est défavorable. Le réarrangement de Pummerer dans l'une de ses étapes de réaction contient une variation de soufre.
Portée
La publication originale de 1951 concernait la conversion du peroxyde de potassium t-butyle et du bromure de 1-phényléthyle en acétophénone et t-butanol avec la pipéridine comme base:
Le réarrangement Kornblum – DeLaMare peut être réalisé sous forme de réaction asymétrique avec une amine chirale appropriée telle que la spartéine ou un alcaloïde de quinquina :
La première étape de cette réaction en un seul pot est la 1,4-dioxygénation du 1,3-cycloheptadiène avec de l'oxygène singulet et un catalyseur TPP .