Phycocyanine - Phycocyanin
| Protéine du phycobilisome | |||||||||
|---|---|---|---|---|---|---|---|---|---|
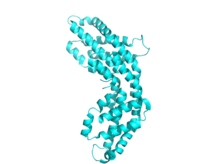
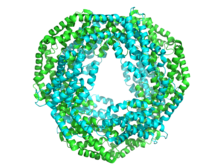
 Allophycocyanine 12-mer PDB 1all
| |||||||||
| Identifiants | |||||||||
| symbole | Phycobilisome | ||||||||
| Pfam | PF00502 | ||||||||
| InterPro | IPR001659 | ||||||||
| SCOP2 | 1cpc / SCOPe / SUPFAM | ||||||||
| |||||||||
La phycocyanine est un complexe pigment- protéine de la famille des phycobiliprotéines récoltant la lumière , avec l' allophycocyanine et la phycoérythrine . C'est un pigment accessoire à la chlorophylle . Toutes les phycobiliprotéines sont solubles dans l'eau, elles ne peuvent donc pas exister dans la membrane comme le peuvent les caroténoïdes . Au lieu de cela, les phycobiliprotéines s'agrègent pour former des amas qui adhèrent à la membrane appelés phycobilisomes . La phycocyanine est une couleur bleu clair caractéristique, absorbant la lumière orange et rouge, en particulier près de 620 nm (selon son type spécifique), et émet une fluorescence à environ 650 nm (selon son type). L'allophycocyanine absorbe et émet à des longueurs d'onde plus longues que la phycocyanine C ou la phycocyanine R. Les phycocyanines se trouvent dans les cyanobactéries (également appelées algues bleu-vert ). Les phycobiliprotéines ont des propriétés fluorescentes qui sont utilisées dans les kits de dosage immunologique . La phycocyanine vient du grec phyco qui signifie « algue » et la cyanine vient du mot anglais « cyan », qui signifie conventionnellement une nuance de bleu-vert (proche de « aqua ») et est dérivé du grec « kyanos » qui signifie un peu couleur différente : "bleu foncé". Le produit phycocyanine, produit par Aphanizomenon flos-aquae et la spiruline , est par exemple utilisé dans l'industrie alimentaire et des boissons comme colorant naturel « Lina Blue » ou « EXBERRY Shade Blue » et se trouve dans les sucreries et les glaces. De plus, la détection par fluorescence des pigments de phycocyanine dans les échantillons d'eau est une méthode utile pour surveiller la biomasse des cyanobactéries.
Les phycobiliprotéines sont constituées de deux sous-unités (alpha et bêta) ayant un squelette protéique auquel 1-2 chromophores tétrapyrroles linéaires sont liés de manière covalente.
La C-phycocyanine se trouve souvent dans les cyanobactéries qui se développent autour des sources chaudes, car elle peut être stable jusqu'à environ 70 °C, avec des comportements spectroscopiques (absorbants de la lumière) identiques à 20 et 70 °C. Les thermophiles contiennent des séquences d'acides aminés légèrement différentes, ce qui les rend stables dans ces conditions plus élevées. Le poids moléculaire est d'environ 30 000 Da. La stabilité de cette protéine in vitro à ces températures s'est avérée sensiblement inférieure. L'analyse photo-spectrale de la protéine après 1 min d'exposition à des conditions de 65 °C à l'état purifié a démontré une perte de 50 % de la structure tertiaire.
Structure
La phycocyanine partage un thème structurel commun avec toutes les phycobiliprotéines . La structure commence par l'assemblage de monomères phycobiliprotéines, qui sont des hétérodimères composés de sous-unités α et , et de leurs chromophores respectifs liés par une liaison thioéther .
Chaque sous-unité est typiquement composée de huit hélices . Les monomères s'agrègent spontanément pour former des trimères annulaires (αβ) 3 , qui présentent une symétrie de rotation et un canal central. Les trimères s'agrègent par paires pour former des hexamères (αβ) 6 , parfois assistés par des protéines de liaison supplémentaires. Chaque tige de phycobilisome a généralement deux ou plusieurs hexamères de phycocyanine. Malgré la similitude globale de la structure et de l'assemblage des phycobiliprotéines, il existe une grande diversité dans les conformations des hexamères et des bâtonnets, même en ne considérant que les phycocyanines. À plus grande échelle , la structure cristalline des phycocyanines varie également , bien que la pertinence biologique de cela soit discutable.
A titre d'exemple, la structure de la C-phycocyanine de Synechococcus vulcanus a été affinée à une résolution de 1,6 Angstrom . Le monomère (αβ) se compose de 332 acides aminés et de 3 molécules de cofacteur de phycocyanobiline (PCB) à liaison thio . Les sous-unités et ont toutes deux un PCB à l'acide aminé 84, mais la sous-unité a également un PCB supplémentaire à la position 155. Ce PCB supplémentaire fait face à l'extérieur de l'anneau trimérique et est donc impliqué dans le transfert d'énergie entre les bâtonnets dans le complexe phycobilisome. En plus des cofacteurs, il existe de nombreuses interactions non covalentes prévisibles avec le solvant environnant (eau) qui sont supposées contribuer à la stabilité structurelle.
La R-phycocyanine II (R-PC II) est présente dans certaines espèces de Synechococcus . On dit que le R-PC II est le premier PEB contenant de la phycocyanine provenant de cyanobactéries. Sa protéine purifiée est composée de sous-unités alpha et bêta en quantités égales. R-PC II a PCB à bêta-84 et la phycoérythrobilline (PEB) à alpha-84 et bêta-155.
Au 7 mars 2018, il y avait 44 structures cristallines de phycocyanine déposées dans la Protein Data Bank .
Caractéristiques spectrales
La C-phycocyanine a un pic d'absorption unique à ~ 621 nm, variant légèrement en fonction de l'organisme et des conditions telles que la température, le pH et la concentration en protéines in vitro . Son émission maximale est de ~642 nm. Cela signifie que le pigment absorbe la lumière orange et émet une lumière rougeâtre. La R-phycocyanine a un maximum d'absorption à 533 et 544 nm. Le maximum d'émission de fluorescence de la R-phycocyanine est de 646 nm.
| Biens | C-Phycocyanine | R-Phycocyanine |
|---|---|---|
| Absorption maximale (nm) | 621 | 533, 544 |
| Émission maximale (nm) | 642 | 646 |
| Coefficient d'extinction (ε) | 1,54x10 6 M -1 cm -1 | - |
| Rendement quantique | 0,81 | - |
Pertinence écologique
La phycocyanine est produite par de nombreuses cyanobactéries photoautotrophes . Même si les cyanobactéries ont de fortes concentrations de phycocyanine, la productivité dans l'océan est encore limitée en raison des conditions de luminosité.
La phycocyanine a une importance écologique en indiquant la prolifération de cyanobactéries. Normalement, la chlorophylle a est utilisée pour indiquer le nombre de cyanobactéries, mais comme elle est présente dans un grand nombre de groupes de phytoplancton, ce n'est pas une mesure idéale. Par exemple, une étude dans la mer Baltique a utilisé la phycocyanine comme marqueur des cyanobactéries filamenteuses pendant les proliférations estivales toxiques. Certains organismes filamenteux de la mer Baltique comprennent Nodularia spumigena et Aphanizomenon flosaquae .
Une cyanobactérie importante nommée spiruline ( Arthrospira plantensis ) est une micro algue qui produit du C-PC.
Il existe de nombreuses méthodes différentes de production de phycocyanine, notamment la production photoautotrophe, mixotrophe et hétérotrophe et recombinante. La production photoautotrophe de phycocyanine est l'endroit où les cultures de cyanobactéries sont cultivées dans des étangs ouverts dans les régions subtropicales ou tropicales. La production mixotrophe d'algues est l'endroit où les algues sont cultivées sur des cultures qui ont une source de carbone organique comme le glucose . L'utilisation de la production mixotrophe produit des taux de croissance et une biomasse plus élevés par rapport à la simple utilisation d'une culture photoautotrophe. Dans la culture mixotrophe, la somme des croissances hétérotrophe et autotrophe séparément était égale à la croissance mixotrophe. La production hétérotrophe de phycocyanine n'est pas limitée par la lumière, selon sa définition. Galdieria sulphuraria est un rhodophyte unicellulaire qui contient une grande quantité de C-PC et une petite quantité d' allophycocyanine . G. sulphuraria est un exemple de production hétérotrophe de C-PC car son habitat est constitué de sources chaudes et acides et utilise un certain nombre de sources de carbone pour sa croissance. La production recombinante de C-PC est une autre méthode hétérotrophe et implique le génie génétique.
Les champignons formant des lichens et les cyanobactéries ont souvent une relation symbiotique et les marqueurs de phycocyanine peuvent donc être utilisés pour montrer la distribution écologique des cyanobactéries associées aux champignons. Comme le montre l'association très spécifique entre les espèces de Lichina et les souches de Rivularia , la phycocyanine a une résolution phylogénétique suffisante pour résoudre l'histoire évolutive du groupe à travers la marge côtière nord-ouest de l'océan Atlantique .
Biosynthèse
Les deux gènes cpcA et cpcB, situés dans l'opéron cpc et traduits à partir du même transcrit d'ARNm, codent respectivement pour les chaînes et de C-PC. Des éléments supplémentaires tels que les protéines de liaison et les enzymes impliquées dans la synthèse de la phycobiline et les phycobiliprotéines sont souvent codés par des gènes dans des groupes de gènes adjacents, et l'opéron cpc d'Arthrospira platensis code également une protéine de liaison aidant à l'assemblage des complexes C-PC. Chez les algues rouges, les gènes de la phycobiliprotéine et de la protéine de liaison sont situés sur le génome du plaste.
La phycocyanobiline est synthétisée à partir de l'hème et insérée dans l'apo-protéine C-PC par trois étapes enzymatiques. L'hème cyclique est oxydé en biliverdine linéaire IXα par l'hème oxygénase et converti en 3Z-phycocyanobiline, l'isomère dominant de la phycocyanobiline, par la 3Z-phycocyanobiline:ferredoxine oxydoréductase. L'insertion de la 3Z-phycocyanobiline dans l'apo-protéine C-PC via la formation de liaisons thioéther est catalysée par la phycocyanobiline lyase.
Le promoteur de l'opéron cpc est situé dans la région amont de 427 pb du gène cpcB. Chez A. platensis , 6 séquences promotrices putatives ont été identifiées dans la région, avec quatre d'entre elles montrant l'expression de la protéine fluorescente verte lorsqu'elle est transformée dans E. coli . La présence d'autres éléments positifs tels que des éléments de réponse à la lumière dans la même région a également été démontrée.
Les multiples séquences de promoteurs et d'éléments de réponse dans l'opéron cpc permettent aux cyanobactéries et aux algues rouges d'ajuster son expression en réponse à de multiples conditions environnementales. L'expression des gènes cpcA et cpcB est régulée par la lumière. Les faibles intensités lumineuses stimulent la synthèse du CPC et d'autres pigments, tandis que la synthèse des pigments est réprimée à des intensités lumineuses élevées. Il a également été démontré que la température affecte la synthèse, avec des concentrations de pigments spécifiques montrant un maximum clair à 36 °C chez Arthronema africanum, une cyanobactérie avec des teneurs particulièrement élevées en C-PC et APC.
La limitation en azote mais aussi en fer induit une dégradation des phycobiliprotéines. Les sources de carbone organique stimulent la synthèse de C-PC chez Anabaena spp., mais semblent n'avoir pratiquement aucun effet effecteur négatif chez A. platensis. Chez les rhodophytes Cyanidium caldarium et Galdieria sulphuraria, la production de C-PC est réprimée par le glucose mais stimulée par l'hème.
Biotechnologie
Des extractions de phycocyanine pure peuvent être isolées à partir d'algues. L'ordre de ségrégation de base est le suivant. La rupture de la paroi cellulaire, avec des forces mécaniques (gel-dégel) ou des agents chimiques (enzymes). Ensuite, C-PC est isolé par centrifugation et purifié par précipitation au sulfate d'ammonium ou chromatographie - soit par filtration ionique, soit par gel . Après, l'échantillon est congelé et séché .
.
Applications
La phycocyanine peut être utilisée dans de nombreuses pratiques, elle est particulièrement utilisée dans des applications médicales et alimentaires. Il peut également être utilisé en génétique, où il agit comme traceur grâce à sa fluorescence naturelle.
Médicament
Anti-oxydant et anti-inflammatoire
La phycocyanine possède à la fois des propriétés antioxydantes et anti-inflammatoires. Les radicaux peroxyle, hydroxyle et alcoxyle sont tous des oxydants piégées par C-PC. C-PC, cependant, a un effet plus important sur les radicaux peroxyles. Le C-PC est un antioxydant liant les métaux car il empêche la peroxydation lipidique de se produire. Les radicaux peroxyles sont stabilisés par le chromophore (une sous-unité de C-PC). Pour que les radicaux hydroxyles soient piégées, cela doit être fait dans une faible luminosité et avec des niveaux élevés de C-PC. Les radicaux hydroxyles se trouvent dans les parties enflammées du corps. Le C-PC, étant un antioxydant, élimine ces radicaux causant des dommages, étant ainsi un agent anti-inflammatoire.
Neuroprotection
L'excès d'oxygène dans le cerveau génère des espèces réactives de l'oxygène (ROS). Les ROS causent des dommages aux neurones du cerveau, entraînant des accidents vasculaires cérébraux. La C-phycocyanine piège le peroxyde d'hydrogène, un type d'espèce ROS, à l'intérieur de l' astrocytes , réduisant ainsi le stress oxydatif. Les astrocytes augmentent également la production de facteurs de croissance comme le BDNF et le NDF, améliorant ainsi la régénération nerveuse. Le C-PC prévient également l' astrogliose et l'inflammation gliale.
Hépatoprotection
La C-phycocyanine s'avère avoir une protection contre l'hépatotoxicité. Vadiraja et al. (1998) ont trouvé une augmentation de la transaminase glutamique pyruvique sérique (SGPT) lorsque la C-PC est traitée contre des heptatoxines telles que le tétrachlorure de carbone (CCl4) ou la R-(+)-pulegone. C-PC protège le foie au moyen du système Cytochrome-P450 . Il peut soit perturber la production de menthofurane, soit perturber la formation de ,β-insaturé-γ-cétoaldéhyde. Les deux sont des composants clés du système du cytochrome P-450 qui produit un métabolite réactif qui produit des toxines lorsqu'il se lie aux tissus hépatiques. Un autre mécanisme de protection possible par C-PC peut être le piégeage des métabolites réactifs (ou des radicaux libres si la cause est CCl4).
Anti-cancer
La C-phycocyanine (C-PC) a des effets anticancéreux. Le cancer survient lorsque les cellules continuent de croître de manière incontrôlable. C-PC a été trouvé pour empêcher la croissance cellulaire. C-PC arrête la formation de tumeur avant la phase S. La synthèse d'ADN n'est pas effectuée en raison de l'entrée de la cellule tumorale dans G0, ce qui n'entraîne aucune prolifération tumorale. De plus, C-PC induit l'apoptose. Lorsque les cellules sont traitées avec C-PC, des ROS (Radical Oxygen Species) sont produites. Ces molécules diminuent la production de BCl-2 (régulateur de l'apoptose). Ici, BCl-2 inhibe les protéines appelées caspases. Les caspases font partie de la voie de l'apoptose. Lorsque BCl-2 diminue, l'expression des caspases augmente. En conséquence, l'apoptose se produit. Le C-PC seul n'est pas suffisant pour traiter le cancer, il doit faire fonctionner d'autres médicaments pour surmonter la nature persistante des cellules tumorales.
Nourriture
La C-phycocyanine (C-PC) peut être utilisée comme colorant alimentaire bleu naturel. Ce colorant alimentaire ne peut être utilisé que pour les produits préparés à basse température en raison de son incapacité à maintenir sa coloration bleue à haute température, sauf ajout de conservateurs ou de sucres. Le type de sucre n'a pas d'importance, le C-PC est stable lorsque la teneur en sucre est élevée. Sachant cela, le C-PC peut être utilisé pour de nombreux types d'aliments, dont les sirops. C-PC peut être utilisé pour des sirops allant du vert au bleu. Il peut avoir différentes teintes vertes en ajoutant des colorants alimentaires jaunes.
Marché
Le marché Phycocyanine devrait croître au cours de la période 2019-2028, car un pigment bleu de phycocyanine a obtenu l’approbation de la FDA en 2013, ce qui a ouvert de nombreuses opportunités pour ce marché et il devrait atteindre 1 milliard USD au cours de la période de prévision 2019-2028.
Les références
Lectures complémentaires
- Barsanti L (2008). "Bizarreries et Curiosités dans le Monde Algal" . Dans Evangelista V, Barsanti L, Frassanito AM, Passarelli V, Gualtieri P (éd.). Toxines d'algues : nature, occurrence, effet et détection . Série A de l'OTAN sur la science au service de la paix et de la sécurité : Chimie et biologie. Dordrecht : Springer. p. 353-391. doi : 10.1007/978-1-4020-8480-5_17 . ISBN 978-1-4020-8479-9.