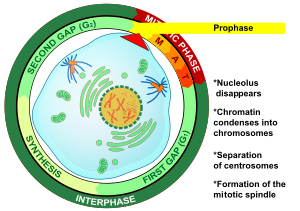
Prophase - Prophase

La prophase (du grec πρό, "avant" et , "stade") est la première étape de la division cellulaire à la fois dans la mitose et la méiose . Commençant après l' interphase , l' ADN a déjà été répliqué lorsque la cellule entre en prophase. Les principaux événements de la prophase sont la condensation du réticulum de la chromatine et la disparition du nucléole .
Coloration et microscopie
La microscopie peut être utilisée pour visualiser les chromosomes condensés à mesure qu'ils traversent la méiose et la mitose .
Diverses colorations d' ADN sont utilisées pour traiter les cellules de sorte que les chromosomes en condensation peuvent être visualisés au cours de la prophase.
La technique des bandes G giemsa est couramment utilisée pour identifier les chromosomes des mammifères , mais l'utilisation de la technologie sur les cellules végétales était difficile en raison du degré élevé de compactage des chromosomes dans les cellules végétales. Les bandes G ont été entièrement réalisées pour les chromosomes des plantes en 1990. Au cours de la prophase méiotique et mitotique , la coloration au giemsa peut être appliquée aux cellules pour déclencher les bandes G dans les chromosomes . La coloration à l'argent, une technologie plus moderne, associée à la coloration au giesma, peut être utilisée pour imager le complexe synaptonémique tout au long des différentes étapes de la prophase méiotique . Pour effectuer des bandes G , les chromosomes doivent être fixés, et il n'est donc pas possible d'effectuer sur des cellules vivantes.
Les colorants fluorescents tels que le DAPI peuvent être utilisés dans les cellules végétales et animales vivantes . Ces colorations ne collent pas les chromosomes , mais permettent plutôt de sonder l'ADN de régions et de gènes spécifiques . L'utilisation de la microscopie à fluorescence a considérablement amélioré la résolution spatiale .
Prophase mitotique
La prophase est la première étape de la mitose dans les cellules animales et la deuxième étape de la mitose dans les cellules végétales . Au début de la prophase, il existe deux copies identiques de chaque chromosome dans la cellule en raison de la réplication en interphase . Ces copies sont appelées chromatides sœurs et sont attachées par un élément d' ADN appelé centromère . Les principaux événements de la prophase sont : la condensation des chromosomes , le mouvement des centrosomes , la formation du fuseau mitotique et le début de la décomposition des nucléoles .
Condensation des chromosomes
L'ADN qui a été répliqué en interphase est condensé à partir de brins d'ADN d'une longueur allant de 0,7 m à 0,2-0,3 m. Ce procédé utilise le complexe de condensine . Les chromosomes condensés sont constitués de deux chromatides sœurs reliées au centromère .
Mouvement des centrosomes
Au cours de la prophase dans les cellules animales , les centrosomes s'éloignent suffisamment les uns des autres pour être résolus à l'aide d'un microscope optique . L' activité des microtubules dans chaque centrosome est augmentée en raison du recrutement de la -tubuline . Les centrosomes répliqués de l' interphase se séparent vers les pôles opposés de la cellule, alimentés par les protéines motrices associées aux centrosomes . Les microtubules interpolaires interdigités de chaque centrosome interagissent les uns avec les autres, aidant à déplacer les centrosomes vers les pôles opposés.
Formation du fuseau mitotique
Les microtubules impliqués dans l' échafaudage d' interphase se décomposent lorsque les centrosomes répliqués se séparent. Le mouvement des centrosomes vers les pôles opposés s'accompagne dans les cellules animales de l'organisation de réseaux individuels de microtubules radiaux (asters) par chaque centromère. Les microtubules interpolaires des deux centrosomes interagissent, rejoignant les ensembles de microtubules et formant la structure de base du fuseau mitotique . Les cellules végétales n'ont pas de centrosomes et les chromosomes peuvent nucléer l' assemblage de microtubules dans l' appareil mitotique . Dans les cellules végétales , les microtubules se rassemblent aux pôles opposés et commencent à former l' appareil à fuseau à des endroits appelés foyers. Le fuseau mitotique est d'une grande importance dans le processus de mitose et finira par séparer les chromatides sœurs en métaphase .
Début de la dégradation des nucléoles
Les nucléoles commencent à se décomposer en prophase, entraînant l'arrêt de la production de ribosomes. Cela indique une redirection de l'énergie cellulaire du métabolisme cellulaire général vers la division cellulaire . L' enveloppe nucléaire reste intacte pendant ce processus.
Prophase méiotique
La méiose implique deux cycles de ségrégation chromosomique et subit donc une prophase deux fois, entraînant la prophase I et la prophase II. La prophase I est la phase la plus complexe de toute la méiose car les chromosomes homologues doivent s'apparier et échanger des informations génétiques . La prophase II est très similaire à la prophase mitotique .
Prophase I
La prophase I est divisée en cinq phases : leptotène, zygotène, pachytène, diplotène et diacinèse. En plus des événements qui se produisent dans la prophase mitotique , plusieurs événements cruciaux se produisent au cours de ces phases, tels que l'appariement de chromosomes homologues et l' échange réciproque de matériel génétique entre ces chromosomes homologues . La prophase I se produit à des vitesses différentes selon l' espèce et le sexe . De nombreuses espèces arrêtent la méiose dans le diplotène de la prophase I jusqu'à l' ovulation . Chez l'homme, des décennies peuvent s'écouler car les ovocytes restent arrêtés en prophase I pour terminer rapidement la méiose I avant l' ovulation .
Leptotène
Dans la première étape de la prophase I, le leptotène (du grec pour "délicat"), les chromosomes commencent à se condenser. Chaque chromosome est à l' état haploïde et se compose de deux chromatides sœurs ; cependant, la chromatine des chromatides sœurs n'est pas encore suffisamment condensée pour être résolue en microscopie . Les régions homologues au sein des paires de chromosomes homologues commencent à s'associer.
Zygotène
Dans la deuxième phase de la prophase I, le zygotène (du grec pour « conjugaison »), tous les chromosomes d' origine maternelle et paternelle ont trouvé leur partenaire homologue . Les paires homologues subissent ensuite une synapsis, un processus par lequel le complexe synaptonémal (une structure protéique) aligne les régions correspondantes de l'information génétique sur les chromatides non sœurs d'origine maternelle et paternelle des paires de chromosomes homologues . Les chromosomes homologues appariés liés par le complexe synaptonémique sont appelés bivalents ou tétrades. Les chromosomes sexuels (X et Y) ne se synapsent pas complètement car seule une petite région des chromosomes est homologue.
Le nucléole passe d'une position centrale à une position périphérique dans le noyau .
Pachytène
La troisième phase de la prophase I, le pachytène (du grec pour "épais"), commence à la fin de la synapsis. La chromatine s'est suffisamment condensée pour que les chromosomes puissent maintenant être résolus en microscopie . Des structures appelées nodules de recombinaison se forment sur le complexe synaptonémal des bivalents . Ces nodules de recombinaison facilitent les échanges génétiques entre les chromatides non sœurs du complexe synaptonémique lors d'un événement appelé croisement ou recombinaison génétique. Plusieurs événements de recombinaison peuvent se produire sur chaque bivalent. Chez l'homme, en moyenne 2 à 3 événements se produisent sur chaque chromosome.
Diplotène
Dans la quatrième phase de la prophase I, diplotène (du grec pour "double"), le croisement est terminé. Les chromosomes homologues conservent un ensemble complet d'informations génétiques; cependant, les chromosomes homologues sont maintenant de descendance maternelle et paternelle mixte. Des jonctions visibles appelées chiasmata maintiennent les chromosomes homologues ensemble aux endroits où la recombinaison s'est produite lors de la dissolution du complexe synaptonémal . C'est à ce stade que l'arrêt méiotique se produit chez de nombreuses espèces .
Diakinèse
Dans la cinquième et dernière phase de la prophase I, la diacinèse (du grec pour "double mouvement"), une condensation complète de la chromatine s'est produite et les quatre chromatides sœurs peuvent être observées en bivalents avec la microscopie . Le reste de la phase ressemblent aux premiers stades de la mitose prométaphase , comme les extrémités de la prophase de la méiose avec l' appareil broche commence à se former, et la membrane nucléaire commence à se décomposer.
Prophase II
La prophase II de la méiose est très similaire à la prophase de la mitose . La différence la plus notable est que la prophase II se produit avec un nombre haploïde de chromosomes par opposition au nombre diploïde dans la prophase mitotique. Dans les cellules animales et végétales, les chromosomes peuvent se décondenser pendant la télophase I, ce qui les oblige à se recondenser pendant la prophase II. Si les chromosomes n'ont pas besoin de se recondenser, la prophase II se déroule souvent très rapidement comme on le voit dans l' organisme modèle Arabidopsis .
Prophase I arrestation
Les femelles mammifères et oiseaux naissent possédant tous les ovocytes nécessaires aux futures ovulations, et ces ovocytes sont arrêtés au stade prophase I de la méiose . Chez l'homme, par exemple, les ovocytes se forment entre trois et quatre mois de gestation au sein du fœtus et sont donc présents à la naissance. Au cours de cette étape d'arrêt de la prophase I ( dictyate ), qui peut durer des décennies, quatre copies du génome sont présentes dans les ovocytes. La signification adaptative de l'arrêt de la prophase I n'est toujours pas entièrement comprise. Cependant, il a été suggéré que l'arrêt des ooctyes au stade des quatre copies du génome pourrait fournir la redondance informationnelle nécessaire pour réparer les dommages dans l'ADN de la lignée germinale . Le processus de réparation utilisé semble être une réparation par recombinaison homologue Les ovocytes arrêtés par la prophase ont une grande capacité de réparation efficace des dommages à l'ADN . La capacité de réparation de l'ADN semble être un mécanisme de contrôle de qualité clé dans la lignée germinale femelle et un déterminant essentiel de la fertilité .
Différences dans la prophase des cellules végétales et animales
La différence la plus notable entre la prophase dans les cellules végétales et les cellules animales se produit parce que les cellules végétales manquent de centrioles . L'organisation de l' appareil à fuseau est plutôt associée à des foyers aux pôles opposés de la cellule ou est médiée par les chromosomes. Une autre différence notable est la préprophase , une étape supplémentaire dans la mitose végétale qui aboutit à la formation de la bande de préprophase , une structure composée de microtubules . Dans la prophase mitotique I des plantes, cette bande disparaît.
Points de contrôle des cellules
La prophase I dans la méiose est l'itération la plus complexe de la prophase qui se produit à la fois dans les cellules végétales et les cellules animales . Pour s'assurer que l'appariement des chromosomes homologues et la recombinaison du matériel génétique se produisent correctement, des points de contrôle cellulaires sont en place. Le réseau de points de contrôle méiotiques est un système de réponse aux dommages de l'ADN qui contrôle la réparation des cassures double brin , la structure de la chromatine , ainsi que le mouvement et l'appariement des chromosomes . Le système se compose de plusieurs voies (y compris le point de contrôle de la recombinaison méiotique ) qui empêchent la cellule d'entrer en métaphase I avec des erreurs dues à la recombinaison.
Voir également
Les références
- ^ un b Nussbaum RL, McInnes RR, Huntington F (2016). Thompson & Thompson Génétique en médecine . Philadelphie : Elsevier. p. 12–20. ISBN 9781437706963.
- ^ A b c Schermelleh L, Carlton PM, S Haase, Shao L, L Winoto, Kner P, et al. (juin 2008). « Imagerie multicolore en subdiffraction de la périphérie nucléaire avec microscopie à illumination structurée 3D » . Sciences . 320 (5881) : 1332–6. Bibcode : 2008Sci ... 320.1332S . doi : 10.1126/science.1156947 . PMC 2916659 . PMID 18535242 .
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y Hartwell LH, Hood L, Goldberg ML, Reynolds AE, Silver LM, Veres RC (2008). La génétique des gènes aux génomes . New York : McGraw-Hill. p. 90-103 . ISBN 978-0-07-284846-5.
- ^ A b c Singh RJ (2017). Cytogénétique des plantes (troisième éd.). Boca Raton, Floride : CBC Press, Taylor & Francis Group. p. 19. ISBN 9781439884188.
- ^ Wang HC, Kao KN (1988). « Les bandes G dans les chromosomes végétaux ». Génome . 30 : 48-51. doi : 10.1139/g88-009 – via ResearchGate.
- ^ Kakeda K, Yamagata H, Fukui K, Ohno M, Fukui K, Wei ZZ, Zhu ES (août 1990). « Bandes à haute résolution dans les chromosomes du maïs par des méthodes de bandes G ». Génétique théorique et appliquée . 80 (2) : 265-72. doi : 10.1007/BF00224397 . PMID 24220906 . S2CID 6600449 .
- ^ Pathak S, Hsu TC (janvier 1979). « Structures colorées à l'argent dans la prophase méiotique des mammifères ». Chromosome . 70 (2) : 195-203. doi : 10.1007/bf00288406 . PMID 85512 . S2CID 27763957 .
- ^ Sumner AT (mai 1982). « La nature et les mécanismes des bandes chromosomiques ». Génétique du cancer et cytogénétique . 6 (1) : 59-87. doi : 10.1016/0165-4608(82)90022-x . PMID 7049353 .
- ^ de Jong H (décembre 2003). « Visualisation des domaines et des séquences d'ADN par microscopie : une histoire de cinquante ans de cytogénétique moléculaire ». Génome . 46 (6) : 943-6. doi : 10.1139/g03-107 . PMID 14663510 .
- ^ a b c d e f g h i j k Taiz L, Zeiger E, Moller IM, Murphy A (2015). Physiologie et développement des plantes . Sunderland MA : Sinauer Associates. p. 35-39. ISBN 978-1-60535-255-8.
- ^ un b Zeng XL, Jiao MD, Wang XG, Chanson ZX, Rao S (2001). "Études au microscope électronique sur le cycle nucléolaire coloré à l'argent de Physarum Polycephalum" (PDF) . Acta Botanica Cinica . 43 (7) : 680-5 . Consulté le 24 février 2015 .
- ^ A b c d e f g Nussbaum RL, RR McInnes, Willard HF (2016). Thompson & Thompson Génétique en médecine . Philadelphie : Elsevier. p. 12–20. ISBN 978-1-4377-0696-3.
- ^ A b c d e f Alberts B, D Bray, Hopkin K, Johnson A, Lewis J, Raff M, K Roberts, Walter P (2004). Biologie cellulaire essentielle . New York NY : Garland Science. p. 639-658 . ISBN 978-0-8153-3481-1.
- ^ Zickler D, Kleckner N (1998). « La transition leptotène-zygotène de la méiose ». Revue annuelle de génétique . 32 : 619-97. doi : 10.1146/annurev.genet.32.1.619 . PMID 9928494 .
- ^ A b c Mira A (Septembre 1998). "Pourquoi la méiose est-elle arrêtée ?". Journal de biologie théorique . 194 (2) : 275-87. Bibcode : 1998JThBi.194..275M . doi : 10.1006/jtbi.1998.0761 . PMID 9778439 .
- ^ A b c Stringer JM, Winship A, Zerafa N, Wakefield M, K Hutt (mai 2020). "Les ovocytes peuvent réparer efficacement les cassures double brin de l'ADN pour restaurer l'intégrité génétique et protéger la santé de la progéniture" . Actes de l'Académie nationale des sciences des États-Unis d'Amérique . 117 (21) : 11513–11522. doi : 10.1073/pnas.2001124117 . PMC 7260990 . PMID 32381741 .
- ^ Hochwagen A, Amon A (mars 2006). "Contrôler ses pauses : mécanismes de surveillance de la recombinaison méiotique" . Biologie actuelle . 16 (6) : R217-28. doi : 10.1016/j.cub.2006.03.009 . PMID 16546077 .
- ^ MacQueen AJ, Hochwagen A (juillet 2011). « Mécanismes de point de contrôle : les marionnettistes de la prophase méiotique ». Tendances en biologie cellulaire . 21 (7) : 393-400. doi : 10.1016/j.tcb.2011.03.004 . PMID 21531561 .
Liens externes
-
 Médias liés à Prophase sur Wikimedia Commons
Médias liés à Prophase sur Wikimedia Commons