Tubuline - Tubulin
| Tubuline | |||||||||
|---|---|---|---|---|---|---|---|---|---|
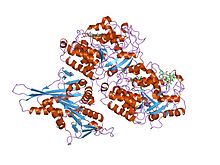 structure complexe tête-microtubule kif1a sous forme atp
| |||||||||
| Identifiants | |||||||||
| symbole | Tubuline | ||||||||
| Pfam | PF00091 | ||||||||
| Clan Pfam | CL0442 | ||||||||
| InterPro | IPR003008 | ||||||||
| PROSITE | PDOC00201 | ||||||||
| SCOP2 | 1tub / SCOPe / SUPFAM | ||||||||
| |||||||||
La tubuline en biologie moléculaire peut faire référence soit à la superfamille des protéines globulaires , soit à l'une des protéines membres de cette superfamille. Les tubulines α et se polymérisent en microtubules , un composant majeur du cytosquelette eucaryote . Les microtubules fonctionnent dans de nombreux processus cellulaires essentiels, y compris la mitose . Les médicaments se liant à la tubuline tuent les cellules cancéreuses en inhibant la dynamique des microtubules, qui sont nécessaires à la ségrégation de l'ADN et donc à la division cellulaire .
Chez les eucaryotes, il y a six membres de la superfamille de la tubuline, bien que tous ne soient pas présents dans toutes les espèces (voir ci - dessous ). Les tubulines α et β ont une masse d'environ 50 kDa et sont donc dans une plage similaire à celle de l' actine (avec une masse d'environ 42 kDa). En revanche, les polymères de tubuline (microtubules) ont tendance à être beaucoup plus gros que les filaments d'actine en raison de leur nature cylindrique.
La tubuline a longtemps été considérée comme spécifique aux eucaryotes . Plus récemment, cependant, il a été démontré que plusieurs protéines procaryotes sont liées à la tubuline.
Caractérisation
La tubuline est caractérisée par la famille Tubuline/FtsZ conservée au cours de l'évolution, le domaine protéique GTPase .
Ce domaine de la protéine GTPase se trouve dans toutes les chaînes de tubuline eucaryotes, ainsi que la bactérie protéine TubZ, la Archaea protéine CetZ et la FtsZ famille de protéines répandue dans les bactéries et les archées .
Fonction
Microtubules
La α et la -tubuline se polymérisent en microtubules dynamiques . Chez les eucaryotes , les microtubules sont l'un des principaux composants du cytosquelette et fonctionnent dans de nombreux processus, notamment le support structurel, le transport intracellulaire et la ségrégation de l'ADN.
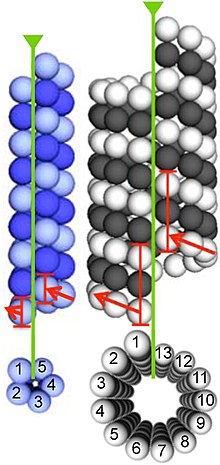
Les microtubules sont assemblés à partir de dimères de - et -tubuline. Ces sous-unités sont légèrement acides avec un point isoélectrique compris entre 5,2 et 5,8. Chacun a un poids moléculaire d'environ 50 kDa.
Pour former des microtubules, les dimères de - et -tubuline se lient au GTP et s'assemblent sur les extrémités (+) des microtubules alors qu'ils sont à l'état lié au GTP. La sous-unité -tubuline est exposée à l'extrémité positive du microtubule tandis que la sous-unité -tubuline est exposée à l'extrémité négative. Une fois le dimère incorporé dans le microtubule, la molécule de GTP liée à la sous-unité -tubuline s'hydrolyse finalement en GDP par des contacts inter-dimères le long du protofilament du microtubule . La molécule GTP liée à la sous-unité α-tubuline n'est pas hydrolysée pendant tout le processus. Le fait que le membre -tubuline du dimère de tubuline soit lié au GTP ou au GDP influence la stabilité du dimère dans le microtubule. Les dimères liés au GTP ont tendance à s'assembler en microtubules, tandis que les dimères liés au GDP ont tendance à se désintégrer ; ainsi, ce cycle GTP est essentiel pour l' instabilité dynamique du microtubule.
Microtubules bactériens
Des homologues de la - et de la -tubuline ont été identifiés dans le genre de bactéries Prosthecobacter . Ils sont désignés BtubA et BtubB pour les identifier comme des tubulines bactériennes. Les deux présentent une homologie à la fois avec la - et la -tubuline. Bien que structurellement très similaires aux tubulines eucaryotes, elles présentent plusieurs caractéristiques uniques, notamment un pliage sans chaperon et une faible dimérisation. La microscopie électronique cryogénique a montré que BtubA/B forme des microtubules in vivo , et a suggéré que ces microtubules ne comprennent que cinq protofilaments, contrairement aux microtubules eucaryotes, qui en contiennent habituellement 13. Des études in vitro ultérieures ont montré que BtubA/B forme des "mini" à quatre brins. -microtubules'.
Division procaryote
FtsZ se trouve dans presque toutes les bactéries et archées , où il fonctionne dans la division cellulaire , se localisant dans un anneau au milieu de la cellule en division et recrutant d'autres composants du divisome, le groupe de protéines qui, ensemble, resserrent l'enveloppe cellulaire pour pincer le cellule, donnant deux cellules filles. FtsZ peut polymériser en tubes, feuilles et anneaux in vitro et forme des filaments dynamiques in vivo .
TubZ fonctionne dans la ségrégation des plasmides à faible nombre de copies pendant la division cellulaire bactérienne . La protéine forme une structure inhabituelle pour un homologue de la tubuline ; deux filaments hélicoïdaux s'enroulent l'un autour de l'autre. Cela peut refléter une structure optimale pour ce rôle puisque la protéine de partitionnement plasmidique non apparentée ParM présente une structure similaire.
Forme de la cellule
CetZ fonctionne dans les changements de forme cellulaire dans les Haloarchaea pléomorphes . Dans Haloferax volcanii , CetZ forme des structures cytosquelettiques dynamiques nécessaires à la différenciation d'une forme cellulaire en forme de plaque en une forme en forme de bâtonnet qui présente une motilité nageuse.
Les types
eucaryote
La superfamille des tubulines comprend six familles (tubulines alpha-(α), bêta-(β), gamma-(γ), delta-(δ), epsilon-(ε) et zêta-(ζ).
-tubuline
Les sous-types de -tubuline humaine comprennent :
-tubuline

Tous les médicaments connus pour se lier à la tubuline humaine se lient à la -tubuline. Ceux-ci comprennent le paclitaxel , la colchicine et les alcaloïdes vinca , dont chacun a un site de liaison distinct sur la -tubuline.
De plus, plusieurs médicaments anti-ver ciblent préférentiellement le site colchicine de la -tubuline chez le ver plutôt que chez les eucaryotes supérieurs. Alors que le mébendazole conserve encore une certaine affinité de liaison avec la -tubuline humaine et de la drosophilie , l' albendazole se lie presque exclusivement à la -tubuline des vers et d'autres eucaryotes inférieurs.
La -tubuline de classe III est un élément microtubulaire exprimé exclusivement dans les neurones et est un identifiant populaire spécifique aux neurones du tissu nerveux. Il se lie à la colchicine beaucoup plus lentement que les autres isotypes de la -tubuline.
La 1-tubuline , parfois appelée β-tubuline de classe VI, est la plus divergente au niveau de la séquence d'acides aminés. Elle est exprimée exclusivement dans les mégacaryocytes et les plaquettes chez l'homme et semble jouer un rôle important dans la formation des plaquettes. Lorsque la β-tubuline de classe VI est exprimée dans des cellules de mammifères, elle provoque une perturbation du réseau de microtubules, la formation de fragments de microtubules et peut finalement provoquer des structures de type bande marginale présentes dans les mégacaryocytes et les plaquettes.
La katanine est un complexe protéique qui sépare les microtubules au niveau des sous-unités -tubuline et est nécessaire pour le transport rapide des microtubules dans les neurones et les plantes supérieures.
Les sous-types de -tubulines humaines comprennent :
-tubuline
La -tubuline, un autre membre de la famille des tubulines, est importante dans la nucléation et l'orientation polaire des microtubules. On le trouve principalement dans les centrosomes et les corps polaires du fuseau , car ce sont les zones de nucléation des microtubules les plus abondantes. Dans ces organites, plusieurs molécules de -tubuline et d'autres protéines se trouvent dans des complexes appelés complexes cycliques de γ-tubuline (γ-TuRC), qui imitent chimiquement l'extrémité (+) d'un microtubule et permettent ainsi aux microtubules de se lier. La -tubuline a également été isolée sous forme de dimère et en tant que partie d'un petit complexe de -tubuline (γTuSC), de taille intermédiaire entre le dimère et la γTuRC. La γ-tubuline est le mécanisme le mieux compris de la nucléation des microtubules, mais certaines études ont indiqué que certaines cellules pourraient être capables de s'adapter à son absence, comme l'indiquent les études de mutation et d' ARNi qui ont inhibé son expression correcte. En plus de former un γ-TuRC pour nucléer et organiser les microtubules, la -tubuline peut se polymériser en filaments qui s'assemblent en faisceaux et en maillages.
Les sous-types de -tubuline humaine comprennent :
Membres du complexe cyclique -tubuline :
δ et -tubuline
Les tubulines delta (δ) et epsilon (ε) se localisent aux centrioles et peuvent jouer un rôle dans la structure et la fonction des centrioles , bien qu'aucune des deux ne soit aussi bien étudiée que les formes α et β.
Les gènes humains de - et -tubuline comprennent :
-tubuline
La zêta-tubuline ( IPR004058 ) est présente chez de nombreux eucaryotes, mais absente chez d'autres, y compris les mammifères placentaires. Il a été démontré qu'il est associé à la structure basale du pied des centrioles dans les cellules épithéliales multiciliées.
Procaryote
BtubA/B
BtubA ( Q8GCC5 ) et BtubB ( Q8GCC1 ) se trouvent dans certaines espèces bactériennes du genre verrucomicrobien Prosthecobacter . Leur relation évolutive avec les tubulines eucaryotes n'est pas claire, bien qu'elles puissent être issues d'une lignée eucaryote par transfert latéral de gènes . Par rapport à d'autres homologues bactériens, ils sont beaucoup plus similaires aux tubulines eucaryotes. Dans une structure assemblée, BtubB agit comme la -tubuline et BtubA agit comme la β-tubuline.
FtsZ
De nombreuses cellules bactériennes et euryarchéotales utilisent FtsZ pour se diviser par fission binaire . Tous les chloroplastes et certaines mitochondries , deux organites dérivés de l' endosymbiose de bactéries, utilisent également FtsZ. Il s'agit de la première protéine cytosquelettique procaryote identifiée.
TubZ
TubZ ( Q8KNP3 ; pBt156) a été identifié dans Bacillus thuringiensis comme essentiel pour le maintien du plasmide . Il se lie à une protéine de liaison à l'ADN appelée TubR ( Q8KNP2 ; pBt157) pour tirer le plasmide autour.
CetZ
CetZ ( D4GVD7 ) se trouve dans les clades euryarchéens de Methanomicrobia et Halobacteria , où il agit dans la différenciation de la forme cellulaire.
Tubulines phagiques
Les phages du genre Phikzlikevirus , ainsi qu'un phage Serratia PCH45, utilisent une protéine shell ( Q8SDA8 ) pour construire une structure semblable à un noyau appelée noyau de phage. Cette structure renferme l'ADN ainsi que la machinerie de réplication et de transcription. Il protège l'ADN du phage des défenses de l'hôte telles que les enzymes de restriction et les systèmes CRISPR- Cas de type I. Une tubuline formant un fuseau , appelée diversement PhuZ ( B3FK34 ) et gp187 , centre le noyau dans la cellule.
Pharmacologie
Les tubulines sont des cibles pour les médicaments anticancéreux comme la vinca- alcaloïde vinblastine et vincristine , et le paclitaxel . Les médicaments anti-ver de mébendazole et d' albendazole ainsi que l' agent anti- goutteux colchicine se lient à la tubuline et inhibent la formation de microtubules. Alors que les premiers conduisent finalement à la mort cellulaire chez les vers, les seconds arrêtent la motilité des neutrophiles et diminuent l' inflammation chez les humains. Le médicament antifongique griséofulvine cible la formation de microtubules et a des applications dans le traitement du cancer.
Modifications post-traductionnelles
Lorsqu'elle est incorporée dans les microtubules, la tubuline accumule un certain nombre de modifications post-traductionnelles , dont beaucoup sont uniques à ces protéines. Ces modifications comprennent la détyrosination , l' acétylation , la polyglutamylation , la polyglycylation , la phosphorylation , l' ubiquitination , la sumoylation et la palmitoylation . La tubuline est également sujette à une modification oxydative et à une agrégation au cours, par exemple, d'une lésion cellulaire aiguë.
De nos jours, il existe de nombreuses recherches scientifiques sur l'acétylation effectuée dans certains microtubules, en particulier celle par la -tubuline N-acétyltransférase (ATAT1) qui joue un rôle important dans de nombreuses fonctions biologiques et moléculaires et, par conséquent, elle est également associée avec de nombreuses maladies humaines, en particulier des maladies neurologiques .
Voir également
Les références
Liens externes
- Tubuline à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis
- CE 3.6.5.6
- Protocoles pour les expériences sur la tubuline
- Infographie de tubuline haute résolution


