Sarcocyste -Sarcocystis
| Sarcocyste | |
|---|---|
|
|
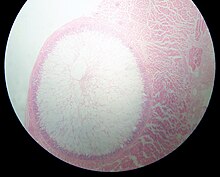
| Kyste de Sarcocystis dans un œsophage de mouton . Le kyste mesure environ 4 mm de diamètre. | |
|
Classement scientifique |
|
| Clade : | DAS |
| Infraroyaume : | Alvéolata |
| Phylum: | Apicomplexe |
| Classer: | Conoidasida |
| Commander: | Eucoccidioridés |
| Famille: | Sarcocystidés |
| Genre: |
Sarcocystis Lankester, 1882 |
| Espèce | |
|
Voir la section Espèces . |
|
Sarcocystis est un genre de parasites protozoaires , la majorité des espèces infectant les mammifères et certaines infectant les reptiles et les oiseaux .
Le cycle de vie d'un membre typique de ce genre implique deux espèces hôtes, un hôte définitif et un hôte intermédiaire. Souvent, l'hôte définitif est un prédateur et l'hôte intermédiaire est sa proie. Le parasite se reproduit sexuellement dans l'intestin de l'hôte définitif, est transmis avec les selles et ingéré par l'hôte intermédiaire. Là, il finit par pénétrer dans le tissu musculaire. Lorsque l'hôte intermédiaire est mangé par l'hôte définitif, le cycle est terminé. L'hôte définitif ne présente généralement aucun symptôme d'infection, contrairement à l'hôte intermédiaire.
Environ 130 espèces reconnues appartiennent à ce genre. La révision de la taxonomie du genre est en cours, et toutes les espèces actuellement reconnues peuvent être un nombre beaucoup plus petit d'espèces pouvant infecter plusieurs hôtes.
Le nom Sarcocystis est dérivé du grec : sarx = chair et kystis = vessie.
Histoire
L'organisme a été reconnu pour la première fois chez une souris par Miescher en 1843. Ses découvertes n'ont pas été initialement interprétées comme impliquant un protiste, et la littérature faisait référence aux structures qu'il a décrites comme « les tubules de Miescher ». Incidemment, le fils de Miescher, Johann Friedrich Miescher , a découvert l' ADN . Des structures similaires ont été trouvées dans le muscle de porc en 1865, mais elles sont restées sans nom jusqu'en 1899, lorsque le nom Sarcocystis miescheriana a été proposé pour eux.
Initialement, il n'était pas clair si ces organismes étaient des champignons ou des protozoaires. Cette incertitude a été levée en 1967 lorsque des études au microscope électronique ont montré qu'il s'agissait de protozoaires, apparentés à Toxoplasma et Eimeria . Le cycle de vie est resté inconnu jusqu'en 1970, lorsque des bradyzoïtes de sarcocystes dans les muscles d'oiseaux ont été inoculés dans des cellules de mammifères en culture et ont vu leur développement se développer en stades sexuels et en oocystes . Des études de transmission avec Sarcocystis de bovins (alors considérés comme une seule espèce, Sarcocystis fusiformis ) chez les chiens, les chats et les humains ont révélé trois espèces morphologiquement distinctes, qui ont été nommées S. bovicanis , S. bovifelis et S. bovihominis . Cette recherche et post-1972 sur Sarcocystis a été examinée au cours de la même décennie.
Cycle de la vie
Le cycle de vie hétéroxène (plus d'un hôte obligatoire) de ces parasites apicomplexes est resté obscur jusqu'en 1972, lorsque la relation proie-prédateur de ses hôtes définitifs et intermédiaires a été reconnue. Les cycles de vie d'environ 60 de ces espèces sont maintenant connus.
Dans les grandes lignes, la gamétogonie et la sporogonie se produisent dans l' intestin de l'hôte définitif, tandis que la schizogonie , qui se produit dans divers tissus, et la formation de sarcocystes (contenant des bradyzoïtes et des métrocytes ) se produisent principalement dans les muscles de l'hôte intermédiaire. Dans certains cas, une même espèce peut agir à la fois comme hôte définitif et intermédiaire.
Les oocystes sont excrétés dans les selles d'un hôte définitif infecté. L'oocyste subit une sporogonie, créant deux sporocystes . Une fois cette opération terminée, l'oocyste lui-même subit une lyse , libérant les sporocystes dans l'environnement. Les sporocystes contiennent généralement quatre sporozoïtes et mesurent 15-19 sur 8-10 μm.
Les hôtes intermédiaires tels que les bovins ou les porcs ingèrent alors des sporocystes. Les sporozoïtes sont ensuite libérés dans le corps et migrent vers les vaisseaux, où ils subissent les deux premières générations de reproduction asexuée. Ces tournées se traduisent par le développement des méronts . Cette étape dure environ 15 à 16 jours après l'ingestion de sporocystes. Les mérozoïtes émergent des mérontes de deuxième génération et pénètrent dans les cellules mononucléées, où ils se développent par endodyogénie . Les générations suivantes de mérozoïtes se développent en aval dans la direction du flux sanguin vers les artérioles, les capillaires, les veinules et les veines dans tout le corps, se transformant ensuite en la génération asexuée finale dans les muscles.
Mérozoïtes entrant dans les cellules musculaires complètent pour former métrocytes et initient sarcocyst formation. Les sarcocystes commencent comme des corps unicellulaires contenant un seul métrocyte et par multiplication asexuée, de nombreux métrocytes s'accumulent et le sarcocyste augmente de taille. À mesure que le sarcocyste mûrit, les petits métrocytes arrondis et non infectieux donnent naissance à des corps en forme de croissant appelés bradyzoïtes (également appelés « mérozoïtes bradyzoïques ») qui sont infectieux pour l'hôte définitif. Le temps nécessaire à la maturation varie selon les espèces et peut prendre 2 mois ou plus.
Chez les espèces chez lesquelles les symptômes se développent, ceux-ci surviennent généralement 20 à 40 jours après l'ingestion de sporocystes et pendant la migration ultérieure des sporozoïtes à travers les vaisseaux corporels. Des lésions aiguës (œdème, hémorragies et nécrose) se développent dans les tissus affectés. Le parasite a une prédilection pour le muscle squelettique (myosite), le muscle cardiaque (hémorragies pétéchiales du muscle cardiaque et des séreuses) et les ganglions lymphatiques (œdème, nécrose et hémorragie). Ces lésions sont associées à la maturation de la deuxième génération de mérontes au sein des cellules endothéliales et sous-endothéliales. Occasionnellement, une infiltration mononucléaire ou une hyperémie a été observée dans la lamina propria de l'intestin grêle. Après la phase aiguë, des kystes peuvent être retrouvés dans divers tissus musculaires, généralement sans pathologie.
Une fois que l'hôte intermédiaire est mangé par l'hôte définitif, tel qu'un chien ou un humain, le parasite subit une reproduction sexuée dans l'intestin pour créer des macrogamonts et des microgamonts . La plupart des hôtes définitifs ne présentent aucun signe ou symptôme clinique. La fusion d'un macrogamont et d'un microgamont crée un zygote qui se transforme en oocyste. L'oocyste passe dans les selles, complétant ainsi le cycle de vie.
Un deuxième cycle de vie a été décrit plus récemment par lequel les carnivores et les omnivores passent les stades infectieux dans leurs selles. L'ingestion de ce matériau peut conduire à une infection réussie de l'animal ingérant.
Des oiseaux
Bien que les sarcocystes aient été signalés pour la première fois dans les muscles des oiseaux par Kuhn en 1865, le premier cycle de vie impliquant un oiseau ( Gallus gallus ) et un carnivore ( Canis familiaris ) n'a été décrit qu'en 1977 par Munday et al. En 1986, le premier cycle de vie impliquant des oiseaux en tant qu'hôtes définitifs (autour des palombes – Accipiter gentilis ) et intermédiaires (canari de l'Atlantique – Serinus canaria ) a été décrit par le Cern et Kvasnovsk.
Taxonomie
La taxonomie de ce genre et sa relation avec d'autres genres de protozoaires sont actuellement à l'étude.
Les genres apparentés comprennent : Besnoitia , Caryospora , Cystoisospora , Frenkelia , Isospora , Hammondia , Hyaloklossia , Lankesterella , Neospora et Toxoplasma .
Sarcocystis est le plus grand genre de la famille des Sarcocystidae et se compose d'espèces qui infectent une gamme d'animaux, notamment des mammifères, des oiseaux et des reptiles. Frenkelia , un autre genre au sein de cette famille, se compose de parasites qui utilisent les rongeurs comme hôtes intermédiaires et les oiseaux de proie comme hôtes définitifs.
Besnoitia , Hammondia , Neospora et Toxoplasma forment apparemment un seul clade . Au sein de ce clade, Toxoplasma et Neospora semblent être des clades frères . Isospora semble également appartenir à ce clade et ce clade est un frère de Sarcocystis . Frenkelia semble être très étroitement liée à Sarcocystis .
Plusieurs études moléculaires ont suggéré que Frenkelia est en fait une espèce de Sarcocystis . Ce genre a été distingué de Sarcocystis sur la base de sa tendance à s'enkyster dans le cerveau plutôt que dans le muscle. Cette distinction peut ne pas être taxonomiquement valide.
Au sein du genre, un certain nombre de clades ont été identifiés. Il s'agit notamment d'un qui contient S. dispersa , S. lacertae , S. mucosa , S. muris , S. neurona et S. rodentifelis . Frenkelia se groupe également avec ce clade.
Espèce
- Sarcocystis accipitris
- Sarcocystis alces
- Sarcocystis alceslatrans
- Sarcocystis ameivamastigodryasi
- Sarcocystis américain
- Sarcocystis arieticanis
- Sarcocystis asinus
- Sarcocystis atheridis
- Sarcocystis aucheniae
- Sarcocystis bertrami
- Sarcocystis bigemina
- Sarcocystis booliati
- Sarcocystis bovicanis
- Sarcocystis bovifelis
- Sarcocystis bovihominis
- Sarcocystis bufflonis
- Sarcocystis calchasi
- Caméli Sarcocystis
- Sarcocystis camelopardalis
- Sarcocystis campestris
- Sarcocystis chamaleonis
- Sarcocystis cerne
- Sarcocystis du col
- Sarcocystis cervicanis
- Sarcocystis canis
- Sarcocystis capracanis
- Sarcocystis cornixi
- Sarcocystis crotali
- Sarcocystis cruzi
- Sarcocystis cuniculi
- Sarcocystis cymruensis
- Sarcocystis danzani
- Sarcocystis dasypi
- Sarcocystis debonei
- Sarcocystis diminuta
- Sarcocystis dirumpens
- Sarcocystis dispersa
- Sarcocystis dubeyella
- Sarcocystis dubeyi
- Sarcocystis equicanis
- Sarcocystis falcatula
- Sarcocystis fayeri
- Sarcocystis felis
- Sarcocystis fulicae
- Sarcocystis fusiformis
- Sarcocystis gallotiae
- Sarcocystis garnhami
- Sarcocystis gracilis
- Sarcocystis grueneri
- Sarcocystis halieti
- Sarcocystis hoarensis
- Sarcocystis fusiformis
- Sarcocystis gallotiae
- Sarcocystis gerbilliechis
- Sarcocystis gigantea
- Sarcocystis giraffae
- Sarcocystis gongyli
- Sarcocystis gracilis
- Sarcocystis greineri
- Sarcocystis grueneri
- Sarcocystis hardangeri
- Sarcocystis hémioni
- Sarcocystis hemionilatrantis
- Sarcocystis hericanis
- Sarcocystis hircicanis
- Sarcocystis hirsuta
- Sarcocystis hjorti
- Sarcocystis hofmanni
- Sarcocystis hominis
- Sarcocystis horvathi
- Sarcocystis iberica
- Sarcocystis idahoensis
- Sarcocystis inghami
- Sarcocystis jamaicensis
- Sarcocystis jorrini
- Sarcocystis kinosterni
- Sarcocystis kirkpatricki
- Sarcocystis kirmsei
- Sarcocystis klaseriensis
- Sarcocystis kortei
- Sarcocystis lacertae
- Sarcocystis lamacanis
- Sarcocystis leporum
- Sarcocystis levinei
- Sarcocystis lindemanni
- Sarcocystis lindsayi
- Sarcocystis linearis
- Sarcocystis medusiformis
- Sarcocystis melis
- Sarcocystis mephitisi
- Sarcocystis miescheriana
- Sarcocystis mihoensis
- Sarcocystis mitrani
- Sarcocystis mongolica
- Sarcocystis montanaensis
- Sarcocystis morae
- Sarcocystis muqueuse
- Sarcocystis moulei
- Sarcocystis murinotechis
- Sarcocystis muris
- Sarcocystis muriviperae
- Sarcocystis neotomafelis
- Sarcocystis nesbitti
- Sarcocystis neurone
- Sarcocystis odoi
- Sarcocystis odocoileocanis
- Sarcocystis ovicanis
- Sarcocystis ovifelis
- Sarcocystis oviformis
- Sarcocystis ovalis
- Sarcocystis phacochoeri
- Sarcocystis phoeniconaii
- Sarcocystis podarcicolubris
- Sarcocystis poephagi
- Sarcocystis poephagicanis
- Sarcocystis porcifelis
- Sarcocystis porcihominis
- Sarcocystis rangi
- Sarcocystis rangiferi
- Sarcocystis rauschorum
- Sarcocystis rileyi
- Sarcocystis rodentifelis
- Sarcocystis roudabushi
- Sarcocystis scandinavica
- Sarcocystis sebeki
- Sarcocystis sibirica
- Sarcocystis sigmodontis
- Sarcocystis silva
- Sarcocystis singaporensis
- Sarcocystis Speeri
- Sarcocystis stehlinii
- Sarcocystis sténodactylicolubris
- Sarcocystis strisi
- Sarcocystis suicanis
- Sarcocystis suihominis
- Sarcocystis sulawesiensis
- Sarcocystis sybillensis
- Sarcocystis tarandi
- Sarcocystis tarandivulpes
- Sarcocystis tenella
- Sarcocystis tilopodi
- Sarcocystis turcicii
- Sarcocystis tudi
- Sarcocystis ursusi
- Sarcocystis venatorium
- Sarcocystis villivilliso
- Sarcocystis wapiti
- Sarcocystis zamani
Évolution
Ces protozoaires se trouvent principalement chez les mammifères. Ils ne semblent pas infecter les mammifères du super-ordre Afrotheria et n'infectent que deux espèces de Xenarthra . En raison de ce modèle, le genre peut avoir évolué dans l'hémisphère nord à partir d'une espèce de protozoaire préexistante qui a infecté des mammifères. Alternativement, parce qu'un certain nombre de marsupiaux australiens sont également infectés par ce genre, les marsupiaux peuvent avoir été les hôtes originaux de ce genre et les parasites ont été propagés dans l'hémisphère nord par les oiseaux. Une troisième possibilité est que le genre a infecté à l'origine des oiseaux et s'est propagé dans le monde entier par ces hôtes. Une dernière possibilité en raison de l'existence de cycles de vie où les hôtes intermédiaires et finaux sont des reptiles, le genre peut provenir des reptiles et s'étendre de là à d'autres genres. La résolution de cette question attend le résultat d'autres études moléculaires.
Clinique : Humain
L'infection par ce parasite est connue sous le nom de sarcosporidiose. En raison de la confusion initiale sur la taxonomie de ce parasite, il était à l'origine appelé Isospora hominis . La littérature plus ancienne peut faire référence à cet organisme.
Épidémiologie
L'infection humaine est considérée comme rare avec moins de 100 cas publiés de maladie invasive (environ 46 cas signalés en 1990). Ces chiffres représentent une sous-estimation flagrante de la charge humaine de morbidité.
Les extrêmes d'âge signalés à ce jour sont un nourrisson de 26 jours et un homme de 75 ans. Des infections ont été signalées en Afrique , en Europe ( Allemagne , Espagne et Pologne ), aux États-Unis ( Californie ), en Amérique centrale et du Sud , en Chine , en Inde , au Tibet , en Malaisie et en Asie du Sud-Est .
Les examens des selles chez les travailleurs thaïlandais ont montré que l'infection à sarcocystis avait une prévalence d'environ 23%. Pratiquement tous les cas semblaient asymptomatiques, ce qui explique probablement le manque de reconnaissance. Une étude de 100 langues humaines obtenues post mortem en Malaisie a révélé un taux d'infection de 21%. Aucune différence entre les sexes n'a été trouvée et la tranche d'âge était de 16 à 57 ans ( moyenne de 37,7 ans).
Une épidémie touchant 93 personnes a été signalée en 2012 en Malaisie. Sarcocystis nesbitti a été confirmé à la cause dans plusieurs cas.
Histoire
Le premier rapport d'infection humaine était par Lindemann en 1868. Bien que plusieurs rapports supplémentaires aient été publiés par la suite, ces premières descriptions n'ont pas été considérées comme définitives. La première description définitive généralement admise de cette maladie a été publiée en 1894 par Baraban et Saint-Rémy. Cette espèce a été nommée par Rivolta d'après Lindemannl en 1898.
Les formes invasives ont été considérées comme appartenant à une seule espèce, S. lindemanni , et la forme intestinale à S. hominis (issu du bœuf insuffisamment cuit) ou S. suihominis (issu du porc insuffisamment cuit). La description de S. lindemanni a depuis été considérée comme insatisfaisante et a été déclarée nomen nudum (un nom sans description). Deux espèces sont actuellement considérées comme capables de provoquer une infection humaine : S. bovihominis ( S. hominis ) et S. suihominis . D'autres espèces, dont S. nesbitti, ont occasionnellement été signalées comme infectant les humains.
Voie d'infection
L'infection se produit lorsque de la viande insuffisamment cuite est ingérée. La période d'incubation est de 9 à 39 jours. Des épidémies humaines se sont produites en Europe. Les rats sont un porteur connu. L'eau contaminée peut provoquer une infection, mais cela reste une possibilité théorique.
Pathologie
La pathologie est de deux types : une forme invasive rare avec vascularite et myosite et une forme intestinale qui se manifeste par des nausées , des douleurs abdominales et des diarrhées . Bien que normalement bénigne et d'une durée inférieure à 48 heures, la forme intestinale peut parfois être sévère, voire mortelle. La forme invasive peut impliquer une grande variété de tissus, notamment les ganglions lymphatiques, les muscles et le larynx .
Caractéristiques cliniques
Dans des études sur des volontaires avec du bœuf infecté, les symptômes sont apparus 3 à 6 heures après avoir mangé. Ceux-ci comprenaient l'anorexie, les nausées, les douleurs abdominales, la distension, la diarrhée, les vomissements, la dyspnée et la tachycardie. Tous les symptômes étaient transitoires et ont duré environ 36 heures. Dans une deuxième série, les symptômes - douleurs abdominales, distension, diarrhée aqueuse et éosinophilie - sont apparus à 1 semaine et ont disparu après 3 semaines.
Des cas cliniques ont été associés à une fièvre aiguë, des myalgies, un bronchospasme, des éruptions cutanées prurigineuses, une lymphadénopathie, des nodules sous-cutanés associés à une éosinophilie, une vitesse de sédimentation érythrocytaire élevée et des taux élevés de créatinine kinase. Les symptômes peuvent durer jusqu'à cinq ans. Une entérite nécrosante segmentaire a été rapportée une fois.
Diagnostic
Diagnostic définitif par biopsie d'un muscle infecté. Les sarcocystes sont identifiables à l' hématoxyline et à l' éosine . La coloration PAS peut être utile, mais une absorption variable de la coloration est courante. Avec les sarcocystes, des cellules inflammatoires peuvent être trouvées. D'autres signes incluent une myosite, une myonécrose, une inflammation périvasculaire et interstitielle, une vascularite et une myosite à éosinophiles.
Traitement
L'infection étant rarement symptomatique, un traitement est rarement nécessaire. Aucun essai n'a été publié, le traitement reste donc empirique. Les agents qui ont été utilisés comprennent l' albendazole , le métronidazole et le cotrimoxazole pour la myosite. Les corticostéroïdes ont également été utilisés pour le soulagement des symptômes.
L'amprolium et la salinomycine ont été efficaces pour prévenir les maladies graves et la mort chez les veaux et les agneaux infectés expérimentalement. Ces agents n'ont pas été essayés chez l'homme à ce jour.
La prévention
L'infection peut être évitée en cuisant la viande avant de la manger. Alternativement, la congélation de la viande à -5°C pendant plusieurs jours avant l'ingestion tue les sporocystes.
Clinique : Non humain

Quatre espèces reconnues infectent les bovins : S. bovifelis , S. bovihominis ( S. hominis ), S. cruzi ( S. bovicanis ) et S. hirsuta . S. cruzi est la seule espèce connue pour être pathogène chez les bovins. Plusieurs syndromes cliniques ont été rapportés en rapport avec ce parasite : myosite à éosinophiles ; les avortements , les mortinaissances et les décès chez les vaches gravides; deux cas d' encéphalite nécrotique chez des génisses ont également été rapportés. Les signes cliniques typiques de la sarcocystose bovine aiguë sont : anorexie , pyrexie (42 °C ou plus), anémie , cachexie , hypertrophie des ganglions lymphatiques palpables , salivation excessive et perte de poils au bout de la queue.
Les moutons peuvent être infectés par quatre espèces reconnues de Sarcocystis : S. arieticanis et S. tenella ( S. ovicanis ) sont pathogènes ; S. gigantea ( S. ovifelis ) et S. medusiformis sont non pathogènes. L'infection par ces parasites est courante aux États-Unis, plus de 80 % des moutons examinés présentant des signes d'infection. S. arieticanis et S. tenella produisent tous deux une maladie extra-intestinale. L'anémie, l'anorexie, l'ataxie et les avortements sont les principaux signes cliniques. Une myosite avec paralysie flasque a été rapportée à la suite d'une infection. La myéloencéphalite ovine à protozoaires est un syndrome reconnu qui peut survenir lors d'épidémies. Les signes pathologiques habituels dans de tels cas sont un œdème et une nécrose de la substance blanche multifocale de la moelle épinière , des nodules gliaux et une encéphalomyélite non suppurée légère à modérée . Le diagnostic peut être établi en trouvant des corps protozoaires (12,7 à 23,0 m) qui colorent immunocytochimiquement les épitopes de Sarcocystis .
Quatre espèces reconnues infectent les porcs : S. medusiformis , S. meischeriana ( S. suicanis ), S. porcifelis et S. suihominis . S. porcifelis est pathogène pour les porcs, provoquant diarrhée, myosite et boiterie.
Cinq espèces infectent les chevaux : S. asinus , S. bertrami , S. equicanis , S. fayeri et S. neurona ( S. falcatula ). Tous utilisent des canidés comme hôtes définitifs ; une infection transplacentaire a également été rapportée. S. neurona provoque une myéloencéphalite à protozoaires équins . L'exposition à ce parasite semble être courante aux États-Unis, des enquêtes sérologiques indiquant que 50 à 60 % de tous les chevaux du Midwest des États-Unis y ont été exposés. Les signes cliniques comprennent des anomalies de la démarche, notamment une ataxie, des articulations et des croisements. Une atrophie musculaire, généralement unilatérale, peut survenir. Les lésions sont généralement focales. L'atteinte du tronc cérébral est fréquente. La dépression, la faiblesse, l'inclinaison de la tête et la dysphagie se produisent également. S. fayeri peut provoquer une myosite chez les chevaux.
Une infection mortelle d'un alpaga ( Lama pacos ) avec une espèce sans nom a été rapportée. Les résultats comprenaient une myosite à éosinophiles disséminée, un avortement et un hémo-abdomen. La myosite était associée à une hémorragie, une nécrose et une dégénérescence. L'infection par S. tilopodi du tissu musculaire du guanaco a été signalée.
S. hemionilatrantis infecte le cerf mulet. La mort par inoculation expérimentale a été signalée.
Ces parasites peuvent également infecter les oiseaux, produisant trois formes cliniques différentes : une maladie pulmonaire aiguë, une maladie musculaire et une maladie neurologique. Les symptômes comprennent la léthargie, l'essoufflement, le balancement de la queue, les fientes teintées de jaune et la mort subite. La présence des kystes dans le muscle des oiseaux sauvages est connue sous le nom de « poitrine de riz ».
Incidence chez les animaux
L'infection par Sarcocystis est fréquente. Les taux chez les porcs varient : 18 % en Iowa , 27 % aux Philippines , 43 % en Espagne, 57 % en Uruguay et 68 % en Inde. Le taux d'infection chez les moutons est généralement supérieur à 90 %. Les chameaux ont une incidence tout aussi élevée d'infection. Des taux supérieurs à 80 % sont connus chez les bovins et les caprins. L'incidence chez les buffles d'eau, les yacks et les hainag dépasse 80% tandis que l'incidence chez les chevaux, les ânes et les poulets est plus faible.
Diagnostic
Le diagnostic est généralement posé post mortem par l'examen du muscle squelettique. Chez certaines espèces, les kystes peuvent être visibles à l'œil nu ( canards , souris , lapins et moutons ), mais dans la plupart, un examen microscopique est requis.
Le diagnostic ante mortem peut être effectué à l'aide de tests de sensibilité cutanée ou de tests de fixation du complément . La biopsie musculaire est également diagnostique, mais elle est beaucoup moins couramment utilisée.
Microscopie
Des oocystes avec deux sporocystes ou des sporocystes individuels dans les selles humaines sont le diagnostic d'une infection intestinale. Ceux-ci apparaissent pour la première fois 14 à 18 jours après l'ingestion de bœuf ( S. hominis ) et 11 à 13 jours après l'ingestion de porc ( S. suihominis ). La flottation basée sur des solutions à haute densité incorporant du chlorure de sodium, du chlorure de césium, du sulfate de zinc, du saccharose, du Percoll, du Ficoll-Hypaque ou d'autres milieux à gradient de densité est préférée au formol-acétate d'éthyle ou à d'autres méthodes de sédimentation. Les sporocystes de S. hominis mesurent en moyenne 9,3 sur 14,7 m et ceux de S. suihominis en moyenne 10,5 sur 13,5 m. En raison du chevauchement des tailles, la taille seule n'est pas fiable comme critère de diagnostic de l'espèce. Une coloration de confirmation avec l'acide périodique de Schiff (PAS) peut être effectuée, car les parois se colorent positivement. De la safranine chauffée + du bleu de méthylène a également été utilisé pour la coloration. L' amplification par PCR de l' ARNr peut également être utilisée.
Parois cellulaires
Les parois du sarcocyste peuvent être utiles dans le diagnostic des espèces avec 24 types de parois identifiés chez 62 espèces. S. hominis et S. suihominis ont tous deux des parois de type 10. La paroi de S. hominis mesure jusqu'à 6 m d'épaisseur et apparaît radialement striée à partir de protubérances villar jusqu'à 7 m de long. Ses bradyzoïtes mesurent de 7 à 9 m de long. La paroi de S. suihominis a une épaisseur de 4 à 9 m, avec des saillies villaneuses atteignant 13 m de long. Ses bradyzoïtes mesurent 15 m de long.
Diagnostic différentiel
Plusieurs autres genres de coccidies hétéroxènes et kystiques sont connus, notamment Besnoitia , Cystoisospora , Frenkelia , Hammondia , Neospora et Toxoplasma . Les genres apparentés mais monoxènes formant des spores comprennent Isospora . Différencier ces genres de Sarcocystis dans le matériel de diagnostic peut être difficile sans coloration immunochimique.
Traitement
Les traitements actuels ne sont pas entièrement satisfaisants. L'amprolium (100 mg/kg, par jour pendant 30 jours), administré à titre prophylactique, a réduit la maladie chez les bovins inoculés avec S. cruzi . L'administration prophylactique d'amprolium ou de salinomycine a également protégé les moutons infectés expérimentalement.
Chez les chevaux, le traitement a été limité aux inhibiteurs de la dihydrofolate réductase tels que les sulfamides et la pyriméthamine . La sulfadiazine (20 mg/kg par voie orale) une ou deux fois par jour est couramment utilisée. Les chevaux infectés doivent également recevoir de la pyriméthamine à la dose de 1,0 mg/kg administrée une fois par jour par voie orale pendant 120 jours ou plus. Le diclazuril et le toltrazuril et d'autres coccidiostatiques sont en cours d'évaluation pour traiter l'EPM.
Vaccination
Aucun vaccin n'est actuellement connu. Les porcs inoculés expérimentalement semblent développer une immunité persistante, donc un vaccin peut être possible.
Relations hôte-parasite
Le cycle de vie du parasite implique généralement un prédateur et une proie. Une seule espèce peut infecter plusieurs proies ou prédateurs. Chez au moins 56 espèces, des hôtes définitifs et intermédiaires sont connus. De nombreuses espèces portent le nom de leurs hôtes reconnus.
Une liste des relations hôte-parasite connues se trouve sur la page Sarcocystis : Relations hôte-parasite .
Génome
S. neurona fait l'objet d'un projet de génome en cours (depuis septembre 2011).
Remarques
Hoareosporidium est maintenant considéré comme un synonyme de Sarcocystis . L'espèce type originale était Sarcocystis miescheriana . Sa description a depuis été considérée comme moins que satisfaisante et S. muris a été proposé comme espèce type. S. tudi n'est peut-être pas une espèce valide.
Isospora bigemina a été reclassée en Sarcocystis bigemina . Isospora hominis a été reclassé en Sarcocystis hominis . S. bovihominis est un synonyme de S. hominis . S. cruzi est un synonyme de S. bovicanis . S. gigantea est un synonyme de S. ovifelis . S. hirsuta est un synonyme de S. bovifelis . S. idahoensis et S. roudabushi peuvent être la même espèce. S. miescheriana est un synonyme de S. suicanis . S. neurona est un synonyme junior de S. falcatula . S. neurima est le nom le plus couramment utilisé pour cette espèce. S. poephagi peut être la même espèce que S. hirsuta . S. poephagicanis peut être la même espèce que S. cruzi . S. tenella est un synonyme de S. ovicanis .
Voir également
Les références
Liens externes
- Sarcocystis à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis
- Projet sur le génome de Sarcocystis
- Critique : Fayer R (2004). "Sarcocystis spp. dans les infections humaines" . Clin. Microbiole. Rév . 17 (4) : 894–902, table des matières. doi : 10.1128/CMR.17.4.894-902.2004 . PMC 523554 . PMID 15489353 .

