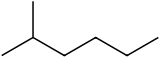
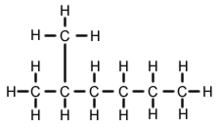
2-Méthylhexane - 2-Methylhexane
|
|
|
|

|
|
| Noms | |
|---|---|
|
Nom IUPAC préféré
2-Méthylhexane |
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| 1696856 | |
| ChemSpider | |
| Carte d'information de l'ECHA |
100.008.847 |
| Numéro CE | |
|
CID PubChem
|
|
| Numéro RTECS | |
| UNII | |
| Numéro ONU | 3295 |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 7 H 16 | |
| Masse molaire | 100,205 g·mol -1 |
| Apparence | Liquide incolore |
| Odeur | Inodore |
| Densité | 0,679 g cm -3 |
| Point de fusion | −119,0 à −117,8 °C ; −182,3 à −180,1 °F ; 154,1 à 155,3 K |
| Point d'ébullition | 89,6 à 90,6 °C ; 193,2 à 195,0 °F ; 362,7 à 363,7 K |
| La pression de vapeur | 15,7 kPa (à 37,7 °C) |
|
Constante de la loi de Henry ( k H ) |
19 nmol Pa -1 kg -1 |
| -86,24·10 -6 cm 3 /mol | |
|
Indice de réfraction ( n D )
|
1,384 |
| Thermochimie | |
|
Capacité calorifique ( C )
|
222,92 JK -1 mol -1 |
|
Entropie molaire standard ( S |
323,34 JK -1 mol -1 |
|
Std enthalpie de
formation (Δ f H ⦵ 298 ) |
−231,1–−228,5 kJ mol −1 |
|
Std enthalpie de
combustion (Δ c H ⦵ 298 ) |
−4.8127–−4.8103 MJ mol −1 |
| Dangers | |
| Pictogrammes SGH |
   
|
| Mention d'avertissement SGH | Danger |
| H225 , H304 , H315 , H336 , H410 | |
| P210 , P261 , P273 , P301+310 , P331 | |
| NFPA 704 (diamant de feu) | |
| point de rupture | −1 °C (30 °F; 272 K) |
| 280 °C (536 °F; 553 K) | |
| Limites d'explosivité | 1–7% |
| Composés apparentés | |
|
Alcanes apparentés
|
|
|
Composés apparentés
|
|
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Références de l'infobox | |
Le 2-méthylhexane ( C 7 H 16 , également appelé isoheptane , éthylisobutylméthane ) est un isomère de l' heptane . C'est structurellement une molécule d' hexane avec un groupe méthyle attaché à son deuxième atome de carbone. Il existe dans la plupart des produits d'heptane disponibles dans le commerce en tant qu'impureté, mais n'est généralement pas considéré comme une impureté en termes de réactions, car il possède des propriétés physiques et chimiques très similaires à celles du n-heptane (heptane à chaîne droite).
Étant un alcane, le 2-méthylhexane est insoluble dans l' eau , mais est soluble dans de nombreux solvants organiques, tels que les alcools et l' éther . Cependant, le 2-méthylhexane est plus communément considéré comme un solvant lui-même. Par conséquent, même s'il est présent dans de nombreux produits à base d'heptane disponibles dans le commerce, il n'est pas considéré comme une impureté destructrice, car l'heptane est généralement utilisé comme solvant. Néanmoins, par des procédés concis de distillation et de raffinage , il est possible de séparer le 2-méthylhexane du n-heptane.
Au sein d'un groupe d'isomères, ceux qui ont plus de branches ont tendance à s'enflammer plus facilement et à brûler plus complètement. Par conséquent, le 2-méthylhexane a une température d'auto-inflammation et un point d'éclair inférieurs à ceux de l'heptane. Théoriquement, le 2-méthylhexane brûle également avec une flamme moins fuligineuse, émettant un rayonnement à plus haute fréquence ; cependant, comme l'heptane et le 2-méthylhexane ne diffèrent que par un atome de carbone , en termes de ramification, les deux brûlent avec une flamme jaune vif lorsqu'ils sont allumés.
Comparé au n-heptane, le 2-méthylhexane a également des points de fusion et d' ébullition inférieurs . Une densité de liquide plus faible se trouve dans le 2-méthylhexane que dans l'heptane.
Sur l' échelle NFPA 704 , le 2-méthylhexane est répertorié comme un produit chimique de niveau de réactivité 0, avec divers autres alcanes . En fait, la plupart des alcanes ne sont pas réactifs, sauf dans des conditions extrêmes, telles que la combustion ou un fort ensoleillement . En présence d' oxygène et de flammes , le 2-méthylhexane, comme l'heptane, se consume presque entièrement en eau et en dioxyde de carbone . Avec la lumière UV et mélangé avec des halogènes dans des solvants, généralement du brome dans du 1,1,1-trichloroéthane , une réaction de substitution se produit.
Voir également
Les références
- " 2-Méthylhexane " . chemexper.com . Récupéré le 22 novembre 2011 .
- "Fiche de données de sécurité" (PDF) . ChemADVISOR . Récupéré le 22 novembre 2011 .
- "Isoheptane" . INCHEM : Informations sur la sécurité chimique des organisations intergouvernementales . Programme international sur la sécurité chimique. Octobre 2002 . Récupéré le 22 novembre 2011 .

