Apigénine - Apigenin
|
|

|
|
| Des noms | |
|---|---|
|
Nom IUPAC
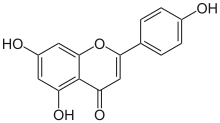
4′,5,7-Trihydroxyflavone
|
|
|
Nom IUPAC préféré
5,7-Dihydroxy-2-(4-hydroxyphényl)-4 H -1-benzopyran-4-one |
|
| Autres noms
Apigénine ; Camomille; Apigénol; Spigénine; Versuline; CI Jaune Naturel 1
|
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Banque de médicaments | |
| Carte d'information de l'ECHA |
100.07.540 |
| KEGG | |
|
CID PubChem
|
|
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 15 H 10 O 5 | |
| Masse molaire | 270,240 g·mol -1 |
| Apparence | Solide cristallin jaune |
| Point de fusion | 345 à 350 °C (653 à 662 °F ; 618 à 623 K) |
| UV-vis (λ max ) | 267, 296sh, 336 nm dans le méthanol |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Références de l'infobox | |
L'apigénine (4′,5,7-trihydroxyflavone), présente dans de nombreuses plantes, est un produit naturel appartenant à la classe des flavones qui est l' aglycone de plusieurs glycosides naturels . C'est un solide cristallin jaune qui a été utilisé pour teindre la laine.
Sources dans la nature
L'apigénine se trouve dans de nombreux fruits et légumes, mais le persil , le céleri , le céleri - rave et le thé à la camomille en sont les sources les plus courantes. L'apigénine est particulièrement abondante dans les fleurs des plantes de camomille, constituant 68% des flavonoïdes totaux . Le persil séché peut contenir environ 45 mg /gramme et la fleur de camomille séchée environ 3 à 5 mg/gramme d'apigénine. La teneur en apigénine du persil frais serait de 215,5 mg/100 grammes, ce qui est beaucoup plus élevé que la deuxième source de nourriture la plus élevée, les cœurs de céleri vert fournissant 19,1 mg/100 grammes.
Biosynthèse
L'apigénine est biosynthétiquement dérivée de la voie générale des phénylpropanoïdes et de la voie de synthèse des flavones. La voie des phénylpropanoïdes part des acides aminés aromatiques L-phénylalanine ou L-tyrosine, tous deux produits de la voie Shikimate . En partant de la L-phénylalanine, l'acide aminé est d'abord désaminé de manière non oxydative par la phénylalanine ammonia lyase (PAL) pour produire du cinnamate, suivi d'une oxydation en position para par la cinnamate 4-hydroxylase (C4H) pour produire du p- coumarate. Comme la L-tyrosine est déjà oxydée en position para , elle saute cette oxydation et est simplement désaminée par la tyrosine ammoniac lyase (TAL) pour arriver au p- coumarate. Pour compléter la voie générale des phénylpropanoïdes, la 4-coumarate CoA ligase (4CL) remplace la coenzyme A (CoA) au niveau du groupe carboxy du p- coumarate. En entrant dans la voie de synthèse des flavones, l' enzyme polykétide synthase de type III chalcone synthase (CHS) utilise des condensations consécutives de trois équivalents de malonyl CoA suivies d'une aromatisation pour convertir le p -coumaroyl-CoA en chalcone. La chalcone isomérase (CHI) isomérise ensuite le produit pour fermer le cycle pyrone pour fabriquer de la naringénine. Enfin, une enzyme flavanone synthase (FNS) oxyde la naringénine en apigénine. Deux types de FNS ont été décrits précédemment ; FNS I, une enzyme soluble qui utilise le 2-oxogluturate, Fe 2+ et l'ascorbate comme cofacteurs et FNS II, une monooxygénase du cytochrome p450 liée à la membrane et dépendante du NADPH.
Glycosides
Les glycosides naturels formés par la combinaison d'apigénine avec des sucres comprennent :
- Apiine (apigénine 7- O -apioglucoside), isolée du persil et du céleri
- Apigetrine (apigénine 7-glucoside), trouvée dans le café de pissenlit
- Vitexine (apigénine 8- C- glucoside)
- Isovitexine (apigénine 6- C- glucosidique)
- Rhoifolin (apigénine 7- O - néohespéridoside )
- Schaftoside (apigénine 6- C -glucoside 8- C -arabinoside)

