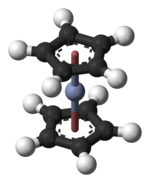
Chromocène - Chromocene
|
|
|||
| Des noms | |||
|---|---|---|---|
|
Nom IUPAC
Bis (η 5 -cyclopentadiényl) chrome (II)
|
|||
| Autres noms
Dicyclopentadiénylchrome (II)
|
|||
| Identifiants | |||
|
Modèle 3D ( JSmol )
|
|||
| ChEBI | |||
| ChemSpider | |||
| Carte Info ECHA | 100.013.670 | ||
| Numéro CE | |||
| 3366 | |||
|
PubChem CID
|
|||
| Numéro RTECS | |||
| UNII | |||
| Numéro UN | 1325 | ||
|
Tableau de bord CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriétés | |||
| C 10 H 10 Cr | |||
| Masse molaire | 182,186 g · mol −1 | ||
| Apparence | cristaux rouge foncé | ||
| Densité | 1,43 g / cm 3 | ||
| Point de fusion | 168 à 170 ° C (334 à 338 ° F; 441 à 443 K) | ||
| Point d'ébullition | Sublimes (sous vide) | ||
| Insoluble | |||
| Structure | |||
| Pseudooctahedral voir Ferrocen |
|||
| 0 J | |||
| Dangers | |||
| Principaux dangers | Pyrophorique | ||
| Pictogrammes SGH |
  
|
||
| Mot de signalisation SGH | Danger | ||
| H302 , H312 , H314 , H315 , H317 , H318 , H319 , H332 , H335 | |||
| NFPA 704 (diamant de feu) | |||
| Composés apparentés | |||
|
Composés apparentés
|
Fe (C 5 H 5 ) 2 Ni (C 5 H 5 ) 2 bis (benzène) chrome- chrome (II) acétate |
||
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 ° C [77 ° F], 100 kPa). |
|||
| Références Infobox | |||
Le chromocène est le composé organochromé de formule [Cr (C 5 H 5 ) 2 ]. Comme les métallocènes structurellement apparentés, le chromocène se sublime facilement dans le vide et est soluble dans les solvants organiques non polaires. Il est plus formellement connu sous le nom de bis (η 5 -cyclopentadiényl) chrome (II).
Synthèse
Ernst Otto Fischer , qui a partagé le prix Nobel de chimie 1973 pour ses travaux sur les composés sandwich , a d'abord décrit la synthèse du chromocène. Une méthode simple de préparation implique la réaction du chlorure de chrome (II) avec le cyclopentadiénide de sodium :
- CrCl 2 + 2 NaC 5 H 5 → Cr (C 5 H 5 ) 2 + 2 NaCl
De telles synthèses sont typiquement conduites dans le tétrahydrofurane . Le décaméthylchromocène, Cr [C 5 (CH 3 ) 5 ] 2 , peut être préparé de manière analogue à partir de LiC 5 (CH 3 ) 5 . Le chromocène peut également être préparé à partir de chlorure de chrome (III) dans un procédé redox :
- 2 CrCl 3 + 6 NaC 5 H 5 → 2 Cr (C 5 H 5 ) 2 + C 10 H 10 + 6 NaCl
Structure et collage
La structure de chromocène a été vérifiée par cristallographie aux rayons X . La longueur moyenne des liaisons Cr – C est de 215,1 (13) pm . Chaque molécule contient un atome de chrome lié entre deux systèmes plans de cinq atomes de carbone connus sous le nom de cycles cyclopentadiényle (Cp) dans un arrangement en sandwich , raison pour laquelle sa formule est souvent abrégée en Cp 2 Cr. Le chromocène est structurellement similaire au ferrocène , le prototype de la classe des métallocènes .
Avec seulement 16 électrons de valence, il ne suit pas la règle des 18 électrons . C'est un composé paramagnétique .
Réactions
La principale réactivité associée au chromocène découle de sa forte réduction et de la labilité des ligands Cp.
Le complexe présente diverses réactions, impliquant généralement le déplacement d'un cycle cyclopentadiényle. La carbonylation a été examinée en détail, conduit finalement à l'hexacarbonyle de chrome. Un intermédiaire est le dimère de tricarbonyle de cyclopentadiénylchrome :
- 2 Cr (C 5 H 5 ) 2 + 6 CO → [Cr (C 5 H 5 ) (CO) 3 ] 2 + "(C 5 H 5 ) 2 "
Le chromocène fournit une voie commode pour préparer la forme anhydre de l' acétate de chrome (II) , un précurseur utile d'autres composés du chrome (II). La réaction implique le déplacement de ligands cyclopentadiényle par formation de cyclopentadiène :
- 4 CH 3 CO 2 H + 2 Cr (C 5 H 5 ) 2 → Cr 2 (O 2 CCH 3 ) 4 + 4 C 5 H 6
Le chromocène se décompose au contact du gel de silice pour donner le catalyseur Union Carbide pour la polymérisation de l' éthylène , bien que d'autres voies de synthèse existent pour la formation de ce catalyseur important.
sécurité
Le chromocène est très réactif vis-à-vis de l'air et pourrait s'enflammer lors d'une exposition à l'atmosphère.
Les références
- ^ Crabtree, RH (2009). La chimie organométallique des métaux de transition (5e éd.). Hoboken, NJ: John Wiley et fils. p. 2. ISBN 978-0-470-25762-3.
- ^ "Le Prix Nobel de Chimie 1973" . Fondation Nobel . Récupéré le 3 décembre 2012 .
- ^ Fischer, EO; Hafner, W. (1953). "Di-cyclopentadiényl-chrom". Z. Naturforsch. B (en allemand). 8 (8): 444–445.
- ^ Fischer, EO; Hafner, W. (1955). "Cyclopentadiényl-Chrom-Tricarbonyl-Wasserstoff". Z. Naturforsch. B (en allemand). 10 (3): 140-143. doi : 10.1515 / znb-1955-0303 .
- ^ Long, NJ (1998). Métallocènes: Introduction aux complexes sandwich . Londres: Wiley-Blackwell. ISBN 978-0632041626.
- ^ Fleur, KR; Hitchcock, PB (1996). "Cristal et structure moléculaire du chromocène (η 5 -C 5 H 5 ) 2 Cr". J. Organomet. Chem . 507 : 275-277. doi : 10.1016 / 0022-328X (95) 05747-D .
- ^ Elschenbroich, C .; Salzer, A. (1992). Organometallics: A Concise Introduction (2e éd.). Wiley-VCH : Weinheim. ISBN 3-527-28165-7.
- ^ Kalousová, Jaroslava; Holeček, Jaroslav; Votinský, Jiři; Beneš, Ludvík (2010). "Das Reaktionsverhalten von Chromocen". Zeitschrift für Chemie . 23 (9): 327–331. doi : 10.1002 / zfch.19830230903 .
- ^ Beneš, L .; Kalousová, J .; Votinský, J. (1985). "Réaction du chromocène avec les acides carboxyliques et certains dérivés de l'acide acétique". J. Organomet. Chem. 290 (2): 147-151. doi : 10.1016 / 0022-328X (85) 87428-3 .