Acide isocyanique - Isocyanic acid
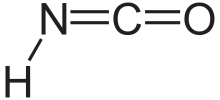
|
|

|
|
| Noms | |
|---|---|
|
Nom IUPAC
Acide isocyanique
|
|
| Autres noms
Carbimide
|
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| Carte d'information de l'ECHA |
100.109.068 |
|
CID PubChem
|
|
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C H N O | |
| Masse molaire | 43,025 g·mol -1 |
| Apparence | Liquide ou gaz incolore (pb proche de la température ambiante) |
| Densité | 1,14 g / cm 3 (20 ° C) |
| Point de fusion | −86 °C (−123 °F; 187 K) |
| Point d'ébullition | 23,5 °C (74,3 °F; 296,6 K) |
| Se dissout | |
| Solubilité | Soluble dans le benzène , le toluène , l' éther |
| Acide conjugué | Oxométhaniminium |
| Base conjuguée | cyanate |
| Dangers | |
| Principaux dangers | Toxique |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Références de l'infobox | |
L'acide isocyanique est un composé chimique de formule structurelle HNCO, qui s'écrit souvent H–N=C=O. C'est une substance incolore, volatile et toxique , avec un point d'ébullition de 23,5 °C. C'est le tautomère prédominant de l'acide cyanique H–O–C≡N.
L' anion dérivé [N=C=O]−
est le même que celui de l'acide cyanique, et est appelé cyanate . Le groupe fonctionnel apparenté –N=C=O est l' isocyanate ; il est distinct du cyanate –O–C≡N, du fulminate –O–N + ≡C − , et de l' oxyde de nitrile –C≡N + –O − .
L'acide isocyanique a été découvert en 1830 par Justus von Liebig et Friedrich Wöhler .
L'acide isocyanique est le composé chimique stable le plus simple qui contient du carbone , de l' hydrogène , de l' azote et de l' oxygène , les quatre éléments les plus couramment trouvés en chimie organique et en biologie. C'est le seul assez stable des quatre isomères linéaires de formule moléculaire HOCN qui ont été synthétisés, les autres étant l'acide cyanique H–O–C≡N et l' acide fulminique insaisissable H–C≡N + –O − et l' acide isofulminique H–O–N + C − .
Structure
Bien que la structure électronique selon la théorie de la liaison de valence puisse être écrite comme HN=C=O, le spectre vibrationnel a une bande à 2268.8 cm -1 en phase gazeuse, ce qui indique clairement une triple liaison carbone-azote. Ainsi la forme canonique H≡C−O − est la structure de résonance majeure .
Propriétés
Physique
Le composé pur a un point de fusion de -86,8 °C et un point d'ébullition de 23,5 °C, il est donc volatil à température ambiante.
Acidité
En solution aqueuse, c'est un acide faible , ayant un p K a de 3,7 :
- HNCO H + + NCO −
Décomposition
L'acide isocyanique s'hydrolyse en dioxyde de carbone et en ammoniac :
- HNCO + H 2 O → CO 2 + NH 3
Oligomérisation
A des concentrations suffisamment élevées, l'acide isocyanique oligomérise pour donner le trimère acide cyanurique et cyamelide , un polymère. Ces espèces sont généralement facilement séparées des produits de réaction en phase liquide ou gazeuse. L'acide cyanurique lui-même se décompose lors d'un nouveau chauffage en acide isocyanique.
Stabilité en solution
Les solutions diluées d' acide isocyanique sont stables dans les solvants inertes , par exemple l' éther et les hydrocarbures chlorés .
Réactions
L'acide isocyanique réagit avec les amines pour donner des urées (carbamides) :
- HNCO + RNH 2 → RNHC(0)NH 2 .
Cette réaction est appelée carbamylation .
HNCO ajoute à travers les doubles liaisons riches en électrons, telles que les éthers de vinyle , pour donner les isocyanates correspondants.
L'acide isocyanique, HNCO, est un acide de Lewis dont l'énergie libre , l' enthalpie et l' entropie changent pour son association 1:1 avec un certain nombre de bases dans une solution de tétrachlorure de carbone à 25°C. Les propriétés d' accepteur de HNCO sont comparées à d' autres acides de Lewis dans le modèle ECW .
Tautomérie
Le tautomère , connu sous le nom d'acide cyanique, HOCN, dans lequel l'atome d'oxygène est protoné, est instable à la décomposition, mais en solution il est présent en équilibre avec l'acide isocyanique à hauteur d'environ 3%. Le spectre vibrationnel indique la présence d'une triple liaison entre les atomes d'azote et de carbone.
La photolyse à basse température des solides contenant du HNCO crée l'acide cyanique tautomère HOC≡N, également appelé cyanate d'hydrogène. L'acide cyanique pur n'a pas été isolé et l'acide isocyanique est la forme prédominante dans tous les solvants. Parfois, les informations présentées pour l'acide cyanique dans les ouvrages de référence concernent en fait l'acide isocyanique.
Préparation
L'acide isocyanique peut être fabriqué par protonation de l' anion cyanate , tel qu'à partir de sels comme le cyanate de potassium , soit par du chlorure d'hydrogène gazeux, soit par des acides tels que l'acide oxalique .
- H + + NCO - → HNCO
Le HNCO peut également être fabriqué par décomposition thermique à haute température du trimère d' acide cyanurique :
- C 3 H 3 N 3 O 3 → 3 HNCO
A l'inverse de la célèbre synthèse d' urée de Friedrich Wöhler ,
- OC(NH 2 ) 2 → HNCO + NH 3
de l'acide isocyanique est produit et se trimérise rapidement en acide cyanurique.
Occurrence
L'acide isocyanique a été détecté dans de nombreux types d' environnements interstellaires .
L'acide isocyanique est également présent dans diverses formes de fumée , notamment le smog et la fumée de cigarette . Il a été détecté à l'aide de la spectrométrie de masse et se dissout facilement dans l'eau , ce qui présente un risque pour la santé des poumons.
Voir également
Les références
Liens externes
- Walter, Wolfgang (1997). Chimie organique: Un texte de diplôme complet et un livre source . Chichester : Éditions Albion. p. 364. ISBN 978-1-898563-37-2. Récupéré le 2008-06-21 .
- Acide cyanique du NIST Chemistry WebBook (consulté le 2006-09-09)
