Plaque de sol - Floor plate
| Plaque de sol | |
|---|---|
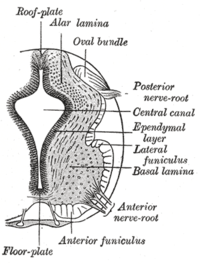 La plaque de sol sépare les plaques basales gauche et droite du tube neural en développement .
| |
| Des détails | |
| Précurseur | Notochord |
| Système | Système nerveux |
| Terminologie anatomique | |
La plaque de sol est une structure intégrée au système nerveux en développement des organismes vertébrés. Située sur la ligne médiane ventrale du tube neural embryonnaire , la plaque de fond est une structure gliale spécialisée qui s'étend sur l'axe antéropostérieur du mésencéphale aux régions de la queue. Il a été montré que la plaque de fond est conservée chez les vertébrés, tels que le poisson zèbre et les souris, avec des structures homologues chez les invertébrés tels que la mouche des fruits Drosophila et le nématode C. elegans . Fonctionnellement, la structure sert d'organisateur pour ventraliser les tissus dans l'embryon ainsi que pour guider le positionnement et la différenciation neuronaux le long de l'axe dorsoventral du tube neural.
Induction
L'induction de la plaque de plancher pendant l'embryogenèse d'embryons de vertébrés a été étudiée de manière approfondie chez le poulet et le poisson zèbre et se produit à la suite d'un réseau de signalisation complexe entre les tissus, dont les détails doivent encore être entièrement affinés. Actuellement, il existe plusieurs lignes de pensée concurrentes. Premièrement, la différenciation de la plaque de plancher peut être médiée par une signalisation inductive à partir de la notocorde sous-jacente , une structure de signalisation dérivée du mésoderme axial . Ceci est soutenu expérimentalement chez le poussin, dans lequel l'induction de la plaque de plancher, ainsi que la différenciation associative du tissu nerveux ventral, est médiée par la molécule de signalisation sécrétée sonic hedgehog (Shh). Shh est exprimé dans un gradient avec la concentration la plus élevée localisée dans la notocorde et la plaque de plancher. Des expériences de greffe de tissu in vitro montrent que l'élimination de cette molécule empêche la différenciation de la plaque de plancher, tandis que son expression ectopique induit la différenciation des cellules de la plaque de plancher. Un autre point de vue propose que les cellules de la plaque de plancher du tube neural proviennent de cellules précurseurs qui migrent directement à partir du mésoderme axial. Grâce à des expériences hybrides poussin-caille ainsi qu'à des expériences d'interaction génétique chez le poisson zèbre, il semble que la notocorde et les cellules de la plaque de plancher proviennent d'un précurseur commun. En outre, chez le poisson zèbre, la signalisation nodale est nécessaire pour la différenciation des cellules de la plaque médiane du plancher, tandis que Shh est consommable. Ces données peuvent indiquer que le mécanisme d'induction de la plaque de plancher chez les amniotes et les anamniotes diffère. Pour concilier ces différences, un modèle d'induction bi-mode a été proposé chez le poussin. Dans ce modèle, les cellules exclusivement ectodermiques sont induites pour devenir une plaque de plancher médian pendant la gastrulation par le mésoderme préchordal, éventuellement par signalisation nodale. Plus tard dans le développement pendant la neurulation , le contact prolongé et l'interaction entre la notocorde et les cellules de la plaque de plancher fatales provoquent une différenciation, suggérant un effet de coopération entre la signalisation Nodal et Shh.
Guidage Axon
Dans le développement du système nerveux central, la décision d'un neurone de traverser ou de ne pas traverser la ligne médiane est critique. Chez les vertébrés, ce choix est médié par la plaque de plancher et permet à l'embryon de développer avec succès des moitiés de corps gauche et droite par rapport au tissu nerveux. Par exemple, alors que les neurones ipsilatéraux ne traversent pas la ligne médiane, les neurones commissuraux traversent la ligne médiane formant une seule commissure. Ces neurones particuliers se développent dans la région dorsale du tube neural et se déplacent ventralement vers la plaque de plancher. En atteignant la plaque de plancher, les neurones commissuraux traversent la structure pour émerger du côté opposé du tube neural, après quoi ils se projettent en avant ou en arrière dans le tube.

- Netrins: Les netrines sont des protéines exprimées et sécrétées par les cellules de la plaque de plancher. Des expériences utilisant des extraits de plaque de plancher et des neurones commissuraux intégrés dans une matrice de collegen montrent une attraction des neurones vers la plaque de plancher in vitro . De plus, l'isolement et la transfection de Netrin-1 et Netrin-2, deux protéines sécrétées, dans des cellules Cos ont des effets similaires. Des recherches plus poussées ont confirmé que les Netrins agissent comme des protéines attractives en plus de Shh pour guider les axones commissuraux vers la plaque de plancher. Les nétrines sont sécrétées par les cellules de la plaque de plancher et fonctionnent pour se lier au récepteur axonique DCC de manière chimiotactique. Des études récentes ont remis en question ce modèle et ont montré que la nétrine-1 dérivée de la plaque de plancher est inutile pour le croisement de la ligne médiane et que la nétrine-1 dérive principalement des progéniteurs de la zone ventriculaire.
- Fente: La fente est un ligand sécrété exprimé dans la plaque de plancher et a pour fonction d'inhiber le croisement axonal du tube neural. Alors que les nétrines attirent les neurones commissuraux vers la ligne médiane, les protéines fendues repoussent et expulsent les neurones de la ligne médiane. En tant qu'axones non destinés à traverser la ligne médiane se projettent à travers le tube neural, ils sont repoussés par la fente du ligand qui est exprimée dans les cellules de la plaque de plancher. Slit agit par l'intermédiaire de ses récepteurs Roundabout (Robo) 1 et 2. Cette interaction inhibe la chimiotaxie fournie par la voie Netrin / DCC. Cependant, Robo-3 (Rig-1) est régulé à la hausse pendant la croissance des axones commissuraux pendant la migration vers la plaque de plancher, qui séquestre Robo-1/2 à l'intérieur de la cellule dans les vésicules. Par conséquent, la voie d'attraction Netrin / DCC domine la voie de répulsion Slit / Robo et l'axone peut se développer vers la ligne médiane et entrer dans la plaque de plancher. En entrant, par un mécanisme pas encore entièrement compris, Robo-3 devient régulé à la baisse et cela libère et régule à la hausse Robo-1/2, repoussant efficacement le neurone de la ligne médiane de la plaque de plancher. Grâce à cette diaphonie complexe de Slit, Robo-1/2 et Robo-3, les axones commissuraux sont guidés vers la ligne médiane pour traverser le tube neural et empêchés de se reculer.
Les molécules de signalisation guidant la croissance et les projections des neurones commissuraux ont des homologues bien étudiés chez les invertébrés. Dans la voie de chimioattraction Netrin / DCC, les homologues de C. elegans sont Unc-6 / Unc-40 et Unc-5, tandis que les homologues de la drosophile sont Netrin-A et Netrin-B / Frazzled et Dunc5. Dans la voie de chimiothérapie Slit / Robo, les homologues de C. elegans sont Slt-1 / Sax-3 tandis que les homologues de Drosophila sont également connus sous le nom de Slit / Robo (1-3).
Cartographie du destin glial
Dans le système nerveux central (SNC), la cartographie globale du destin cellulaire est généralement dirigée par la voie de signalisation du morphogène sonic hedgehog (Shh). Dans la moelle épinière, Shh est dirigé à la fois par les régions de la notocorde et de la plaque de plancher, ce qui entraîne finalement l'organisation des populations de progéniteurs neuraux et gliaux. Les populations gliales spécifiques impactées par Shh dans ces deux régions comprennent les cellules précurseurs d'oligodendrocytes (OPC), les oligodendrocytes , les cellules NG2 +, les microglies et les astrocytes . La région de la plaque de plancher (FP) de la moelle épinière contribue individuellement à la gliogenèse ou à la formation de cellules gliales. Traditionnellement, les cellules progénitrices sont conduites de leur phase d'expansion progénitrice à la phase neurogène et finalement à la phase gliogénique. A partir de la phase gliogénique, les anciennes cellules progénitrices peuvent alors devenir des astrocytes, des oligodendrocytes ou d'autres types de cellules gliales plus spécialisées. Récemment, des efforts ont été faits pour utiliser la mutagenèse conditionnelle pour inactiver sélectivement la voie Shh spécifiquement dans la région FP afin d'identifier différents rôles des molécules impliquées dans le devenir des cellules oligodendrocytes. Les oligodendrocytes sont les cellules responsables de la myélinisation des axones dans le SNC.
Shh régule le traitement de Gli à travers deux protéines, Ptch1 et Smo . Lorsque Shh n'est pas actif, Ptch1 est responsable de la suppression de la voie à travers l'inhibition de Smo. Smo est crucial pour la transduction globale du signal de la voie Shh. Si Smo est inhibé, la voie Shh est également inactive, ce qui réprime finalement la gliogenèse. Des facteurs spécifiques tels que Gli3 sont nécessaires pour le devenir des cellules oligodendrocytes. Puisque Shh régule le traitement Gli, si Smo est compromis ou inhibé par Ptch1, cela inactive la voie Shh et empêche le traitement Gli qui perturbe la cartographie du destin des cellules gliales. La signalisation Shh dans la région FP est très importante car elle doit être active pour que la gliogenèse se produise. Si Shh est inactivé dans la région FP et activé dans d'autres régions de la moelle épinière telles que les domaines Dbx ou pMN, la gliogenèse est compromise. Mais, lorsque Shh est actif dans la région FP, la gliogenèse est activée et les cellules gliales commencent à migrer vers leurs destinations ciblées pour fonctionner.
Lésion médullaire et régénération axonale
La région de la plaque de plancher facilite le guidage axonal, la cartographie du destin glial et l' embryogenèse . Si cette zone de la moelle épinière est lésée, il pourrait y avoir des complications graves à toutes les fonctions contributives de cette région, à savoir une prolifération et une production limitées des cellules gliales responsables de la myélinisation et de la phagocytose dans le SNC. Les lésions de la moelle épinière (SCI) entraînent également le plus souvent une dénudation ou une séparation des axones. La signalisation Wnt est une voie de signalisation courante impliquée dans les cas de blessure. La signalisation Wnt régule la régénération après une lésion de la moelle épinière. Immédiatement après la blessure, l'expression de Wnt augmente considérablement. Le guidage Axon est piloté par la Netrin-1 dans la région FP de la moelle épinière. Pendant les cas de blessure, en particulier les cas de séparation des axones, la signalisation Wnt est régulée à la hausse et les axones commencent à initier la régénération et les axones sont réguidés à travers les régions FP en utilisant les voies de signalisation Shh et Wnt.
Les cellules épendymales de la moelle épinière résident également dans la région FP de la moelle épinière. Ces cellules sont une population de cellules souches neurales responsables du repeuplement des cellules perdues lors d'une blessure. Ces cellules ont la capacité de se différencier en populations gliales progénitrices. Lors d'une blessure, un facteur intitulé Akhirin est sécrété dans la région FP. Au cours du développement de la moelle épinière, l' Akhirine est exprimée uniquement sur les cellules souches épendymaires aux propriétés latentes des cellules souches et joue un rôle clé dans le développement de la moelle épinière. En l'absence d'Akhirin, la souche de ces cellules épendymaires n'est pas régulée. La lésion compromet l'expression et la régulation de l'Akhirine et les cellules de la région FP ne peuvent pas être correctement restaurées par les populations de cellules souches épendymales.
