Gamma sécrétase - Gamma secretase
| Gamma-sécrétase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
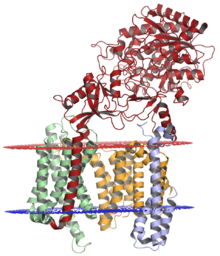 Le complexe gamma sécrétase, avec la nicastrine (rouge), la préséniline-1 (orange), le PEN-2 (bleu) et l' APH-1 (vert) ; membrane luminale représentée en rouge et membrane cytoplasmique représentée en bleu. La structure a été résolue par cryomicroscopie électronique .
| |||||||||
| Identifiants | |||||||||
| symbole | Gamma-sécrétase | ||||||||
| Pfam | PF05450 | ||||||||
| InterPro | IPR008710 | ||||||||
| superfamille OPM | 244 | ||||||||
| protéine OPM | [ 5fn5[ | ||||||||
| Membraneux | 155 | ||||||||
| |||||||||
La gamma sécrétase est un complexe de protéase à plusieurs sous-unités , elle-même une protéine membranaire intégrale , qui clive les protéines transmembranaires à un seul passage au niveau des résidus dans le domaine transmembranaire. Les protéases de ce type sont appelées protéases intramembranaires . Le substrat le plus connu de la gamma sécrétase est la protéine précurseur amyloïde , une grande protéine membranaire intégrale qui, lorsqu'elle est clivée à la fois par la gamma et la bêta sécrétase , produit un court peptide de 37 à 43 acides aminés appelé bêta amyloïde dont la forme fibrillaire anormalement repliée est la principale composant des plaques amyloïdes présentes dans le cerveau des patients atteints de la maladie d'Alzheimer . La gamma sécrétase est également critique dans le traitement connexe de plusieurs autres protéines membranaires intégrales de type I, telles que Notch , ErbB4 , E-cadhérine , N-cadhérine , éphrine-B2 ou CD44 .
Sous-unités et assemblage
Le complexe gamma sécrétase se compose de quatre protéines individuelles : PSEN1 (préséniline-1), nicastrine , APH-1 (pharynx antérieur défectueux 1) et PEN-2 (amplificateur de préséniline 2). Des preuves récentes suggèrent qu'une cinquième protéine, connue sous le nom de CD147 , est un régulateur non essentiel du complexe dont l'absence augmente l'activité. La préséniline , une aspartyl protéase , est la sous- unité catalytique ; Il a été démontré que les mutations du gène de la préséniline sont un facteur de risque génétique majeur de la maladie d'Alzheimer et modulent l'activité des cellules immunitaires. Chez l'homme, deux formes de préséniline et deux formes d'APH-1 ont été identifiées dans le génome ; l'un des homologues de l'APH peut également être exprimé sous deux isoformes via un épissage alternatif , conduisant à au moins six complexes différents possibles de gamma-sécrétase qui peuvent avoir une spécificité de type tissulaire ou cellulaire.
Les protéines du complexe gamma sécrétase sont fortement modifiées par protéolyse lors de l'assemblage et de la maturation du complexe ; une étape d'activation requise est le clivage autocatalytique de la préséniline en fragments N- et C-terminaux. Le rôle principal de la nicastrine est de maintenir la stabilité du complexe assemblé et de réguler le trafic de protéines intracellulaires. PEN-2 s'associe au complexe via la liaison d'un domaine transmembranaire de la préséniline et, entre autres rôles possibles, aide à stabiliser le complexe après que la protéolyse de la préséniline a généré les fragments N-terminaux et C-terminaux activés . APH-1, qui est requis pour l'activité protéolytique, se lie au complexe via un motif d' interaction en hélice alpha conservé et aide à initier l'assemblage de composants prématurés.
Des recherches récentes ont montré que l'interaction du complexe gamma sécrétase avec la protéine d'activation de la -sécrétase facilite le clivage gamma de la protéine précurseur de l' amyloïde en β-amyloïde .
Trafic cellulaire
On pense que le complexe gamma sécrétase s'assemble et mûrit par protéolyse dans le réticulum endoplasmique précoce . Les complexes sont ensuite transportés vers le RE tardif où ils interagissent avec et clivent leurs protéines substrats. Des complexes gamma sécrétase ont également été observés localisés dans les mitochondries , où ils pourraient jouer un rôle dans la promotion de l' apoptose .
Fonction
La gamma sécrétase est une protéase interne qui clive dans le domaine transmembranaire de ses protéines substrats , y compris la protéine précurseur amyloïde (APP) et Notch . La reconnaissance du substrat se produit via la liaison de l'ectodomaine de la nicastrine à l'extrémité N-terminale de la cible, qui est ensuite transmise via un processus mal compris entre les deux fragments de préséniline à un site actif contenant de l' eau où se trouve le résidu aspartate catalytique . Le site actif doit contenir de l'eau pour effectuer l' hydrolyse dans un environnement hydrophobe à l'intérieur de la membrane cellulaire , bien qu'on ne comprenne pas bien comment l' échange d' eau et de protons est effectué, et jusqu'à présent aucune structure de cristallographie aux rayons X de la gamma sécrétase n'est disponible. . Des reconstructions en microscopie électronique à basse résolution ont permis de visualiser les pores internes hypothétiques d'environ 2 nanomètres. En 2014, une structure tridimensionnelle d'un complexe de gamma-sécrétase humaine intacte a été déterminée par analyse de particules uniques en microscopie cryoélectronique à une résolution de 4,5 angströms et en 2015, une structure cryo-EM à résolution atomique (3,4 angströms) a été signalée.
Le complexe gamma-secrétase est inhabituel parmi les protéases en ce qu'il possède un site de clivage « sloppy » au niveau du site C-terminal dans la génération de bêta-amyloïde ; La gamma sécrétase peut cliver l'APP dans n'importe lequel de plusieurs sites pour générer un peptide de longueur variable, le plus souvent de 39 à 42 acides aminés, avec Aβ40 l'isoforme la plus courante et Aβ42 la plus sensible aux changements de conformation conduisant à la fibrillogenèse amyloïde . Certaines mutations à la fois dans l'APP et dans les deux types de préséniline humaine sont associées à une production accrue d'Aβ42 et à la forme génétique précoce de la maladie d'Alzheimer familiale . Bien que des données plus anciennes suggèrent que différentes formes du complexe gamma-sécrétase pourraient être différemment responsables de la génération de différentes isoformes bêta-amyloïdes, les preuves actuelles indiquent que l'extrémité C-terminale de la bêta-amyloïde est produite par une série de clivages de résidus uniques par le même complexe gamma-sécrétase. . Les sites de clivage antérieurs produisent des peptides de longueur 46 (clivage zêta) et 49 (clivage epsilon).
Voir également
- DAPT (chimique) , un inhibiteur de la γ-sécrétase
