Heck réaction - Heck reaction
| Heck réaction | |
|---|---|
| Nommé après | Richard F. Heck |
| Type de réaction | Réaction de couplage |
| Identifiants | |
| Portail de la chimie organique | diable-réaction |
| ID d'ontologie RSC | RXNO: 0000024 |
La réaction de Heck (également appelée réaction de Mizoroki-Heck ) est la réaction chimique d'un halogénure insaturé (ou triflate ) avec un alcène en présence d'une base et d'un catalyseur au palladium (ou catalyseur à base de nanomatériaux de palladium ) pour former un alcène substitué . Il porte le nom de Tsutomu Mizoroki et Richard F. Heck . Heck a reçu le prix Nobel de chimie 2010 , qu'il a partagé avec Ei-ichi Negishi et Akira Suzuki , pour la découverte et le développement de cette réaction. Cette réaction était le premier exemple d'une réaction de formation de liaison carbone-carbone qui a suivi un cycle catalytique Pd (0) / Pd (II), le même cycle catalytique que celui observé dans d'autres réactions de couplage croisé catalysées par Pd (0) . La réaction de Heck est un moyen de remplacer les alcènes.
| La réaction de Heck |
|---|
L'histoire
La réaction originale de Tsutomu Mizoroki (1971) décrit le couplage entre l' iodobenzène et le styrène dans le méthanol pour former du stilbène à 120 ° C ( autoclave ) avec une base d' acétate de potassium et une catalyse au chlorure de palladium . Ce travail était une extension des travaux antérieurs de Fujiwara (1967) sur le couplage médié par le Pd (II) des arènes (Ar – H) et des alcènes et des travaux antérieurs de Heck (1969) sur le couplage des halogénures arylmercuriques (ArHgCl) avec les alcènes en utilisant une quantité stoechiométrique d'une espèce de palladium (II).
| Mizoroki 1971 |
|---|
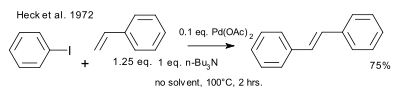
En 1972, Heck a reconnu la publication de Mizoroki et détaillé des travaux découverts indépendamment . Les conditions de réaction diffèrent par le catalyseur utilisé (acétate de palladium) et la charge du catalyseur (0,01 éq.), La base utilisée (une amine encombrée) et le manque de solvant.
| Heck 1972 |
|---|
Dans ces réactions, le catalyseur actif Pd (0) (voir mécanisme de réaction) est formé par coordination du Pd avec l'alcène.
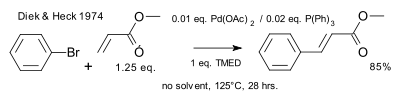
En 1974, Heck a introduit des ligands phosphine dans l'équation.
| Heck réaction 1974 phosphines |
|---|
Catalyseur et substrats
La réaction est catalysée par des sels et des complexes de palladium. Les catalyseurs et précatalyseurs typiques comprennent le tétrakis (triphénylphosphine) palladium (0) , le chlorure de palladium et l'acétate de palladium (II) . Les ligands de support typiques sont la triphénylphosphine , le PHOX et le BINAP . Les bases typiques sont la triéthylamine , le carbonate de potassium et l'acétate de sodium .
L'électrophile aryle peut être un halogénure (Br, Cl) ou un triflate ainsi que des halogénures de benzyle ou de vinyle . L'alcène doit contenir au moins une liaison sp 2 -CH. Les substituants attracteurs d'électrons améliorent la réaction, les acrylates sont donc idéaux.
Mécanisme de réaction
Le mécanisme implique des intermédiaires organopalladium . Le composé de palladium (0) requis dans ce cycle est généré in situ à partir d'un précurseur de palladium (II).
Par exemple, l'acétate de palladium (II) est réduit par la triphénylphosphine en bis (triphénylphosphine) palladium (0) ( 1 ) et la triphénylphosphine est oxydée en oxyde de triphénylphosphine. L'étape A est une addition oxydante dans laquelle le palladium s'insère dans la liaison aryle à bromure. Le palladium forme alors un complexe π avec l'alcène ( 3 ) et à l'étape B l'alcène s'insère dans la liaison palladium-carbone dans une étape d' addition syn . S'ensuit ensuite une rotation de détente de torsion vers l'isomère trans (non représenté) et l'étape C est une étape d' élimination du bêta-hydrure (ici les flèches montrent le contraire) avec la formation d'un nouveau complexe palladium - alcène π ( 5 ). Ce complexe est détruit à l'étape suivante. Le palladium (0) composé est régénéré par élimination réductrice du composé de palladium (II) par du carbonate de potassium dans l'étape finale, D . Au cours de la réaction, le carbonate est consommé de manière stoechiométrique et le palladium est vraiment un catalyseur et utilisé en quantités catalytiques. Un cycle de palladium similaire mais avec des scènes et des acteurs différents est observé dans le processus Wacker .
| Mécanisme de réaction Heck |
|---|
Ce cycle n'est pas limité aux composés vinyliques, dans le couplage Sonogashira l' un des réactifs est un alcyne et dans le couplage Suzuki l'alcène est remplacé par un acide aryl boronique et dans la réaction de Stille par un arylstannane . Le cycle s'étend également à l'autre élément du groupe 10 nickel par exemple dans le couplage Negishi entre halogénures d'aryle et composés organozinciques. Le platine forme des liaisons fortes avec le carbone et n'a pas d'activité catalytique dans ce type de réaction.
Stéréosélectivité
Cette réaction de couplage est stéréosélective avec une propension au trans- couplage car le groupe halogénure de palladium et le résidu organique volumineux s'éloignent l'un de l'autre dans la séquence de réaction dans une étape de rotation. La réaction de Heck est appliquée industriellement à la production de naproxène et du composant écran solaire octyl méthoxycinnamate . La synthèse du naproxène comprend un couplage entre un composé naphtalène bromé avec de l' éthylène :
| La réaction de Heck dans la production de naproxène |
|---|
Variations
Réaction de Heck liquide ionique
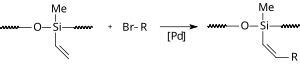
En présence d'un liquide ionique, une réaction de Heck se déroule en l'absence d'un ligand phosphore. Dans une modification, l'acétate de palladium et le liquide ionique (bmim) PF 6 sont immobilisés à l'intérieur des cavités de gel de silice en phase inverse . De cette manière, la réaction se déroule dans l'eau et le catalyseur est réutilisable.
| Application de siloxane |
|---|
Heck oxyarylation
Dans la modification d' oxyarylation de Heck , le substituant palladium dans l'intermédiaire d'addition syn est déplacé par un groupe hydroxyle et le produit de réaction contient un cycle dihydrofurane .
| Heck oxyarylation |
|---|
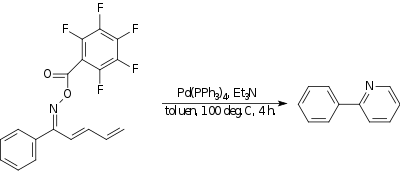
Réaction Amino-Heck
Dans la réaction amino-Heck un azote à carbone liaison est formée. Dans un exemple, un oxime avec un groupe fortement attracteur d'électrons réagit de manière intramoléculaire avec l'extrémité d'un diène pour former un composé pyridine . Le catalyseur est le tétrakis (triphénylphosphine) palladium (0) et la base est la triéthylamine .
| Réaction Amino-Heck |
|---|
Voir également
- Accouplement Hiyama
- Réaction de Stille
- Réaction de Suzuki
- Couplage Sonogashira
- Réaction de Heck intramoléculaire
Les références
Liens externes
- La réaction de Heck sur organic-chemistry.org Article
- Heck réaction: protocoles synthétiques de organic-reaction.com