Hydroamination - Hydroamination
L'hydroamination est l'addition d'une liaison NH d'une amine sur une liaison multiple carbone-carbone d'un alcène , alcyne , diène ou allène . Dans le cas idéal, l'hydroamination est économe en atomes et verte . Les amines sont courantes dans les industries de la chimie fine, pharmaceutique et agricole. L'hydroamination peut être utilisée par voie intramoléculaire pour créer des hétérocycles ou par voie intermoléculaire avec une amine et un composé insaturé séparés. Le développement de catalyseurs d'hydroamination reste un domaine actif, notamment pour les alcènes. Bien que des réactions d'hydroamination pratiques puissent être effectuées pour les diènes et les alcènes électrophiles, le terme hydroamination implique souvent des réactions de processus catalysés par un métal.
Histoire
L'hydroamination est une technologie bien établie pour générer des parfums à partir du myrcène . Dans cette conversion, la diéthylamine s'ajoute à travers le substituant diène, la réaction étant catalysée par le diéthylamide de lithium. Des hydroaminations intramoléculaires ont été signalées par Tobin J. Marks en 1989 à l'aide de métallocène dérivé de métaux des terres rares tels que le lanthane , le lutécium et le samarium . Les vitesses catalytiques étaient inversement corrélées avec le rayon ionique du métal, peut-être en raison de l' interférence stérique des ligands. En 1992, Marks a développé les premiers catalyseurs d'hydroamination chiraux en utilisant un auxiliaire chiral, qui ont été les premiers catalyseurs d'hydroamination à favoriser un seul stéréoisomère spécifique . Des auxiliaires chiraux sur les ligands métallocènes ont été utilisés pour dicter la stéréochimie du produit. Les premiers catalyseurs chiraux non métallocènes ont été signalés en 2003, et utilisaient des ligands bisarylamido et aminophénolate pour donner une énantiosélectivité plus élevée .
Portée de la réaction
L'hydroamination a été examinée avec une variété d'amines, de substrats insaturés et de catalyseurs très différents. Les amines qui ont été étudiées couvrent un large éventail, y compris les anilines primaires, secondaires, cycliques, acycliques et avec divers substituants stériques et électroniques . Les substrats insaturés qui ont été étudiés comprennent les alcènes, les diènes, les alcynes et les allènes. Pour l'hydroamination intramoléculaire, divers aminoalcènes ont été examinés.
Des produits
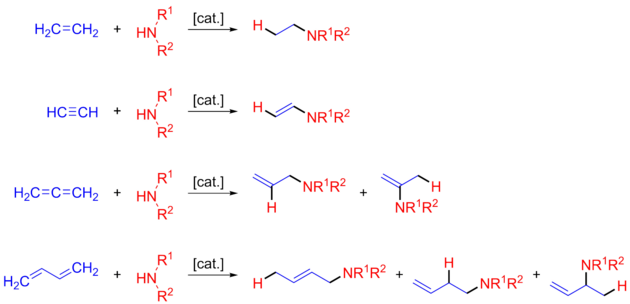
L'addition à travers la liaison carbone-carbone insaturée peut être Markovnikov ou anti-Markovnikov selon le catalyseur. En considérant la possible chiralité R/S, quatre produits peuvent être obtenus : Markovnikov avec R ou S et addition anti-Markovnikov avec R ou S. Bien qu'il y ait eu de nombreux rapports d'hydroamination catalytique avec une large gamme de métaux, il y a beaucoup moins décrivant la catalyse énantiosélective pour fabriquer sélectivement l'un des quatre produits possibles. Récemment, il y a eu des rapports de fabrication sélective du produit thermodynamique ou cinétique , qui peut être lié aux structures racémiques de Markovnikov ou anti-Markovnikov (voir Produit thermodynamique et cinétique ci-dessous).
Catalyseurs et cycle catalytique
Les réactions d'hydroamination sont des procédés efficaces en termes d' atomes qui utilisent généralement des matériaux de départ facilement disponibles et bon marché. Par conséquent, une stratégie catalytique générale est hautement souhaitable. De plus, les stratégies d'hydroamination catalytique directe présentent en principe des avantages significatifs par rapport aux méthodes plus classiques pour préparer des composés contenant des amines, y compris la réduction du nombre d'étapes de synthèse nécessaires.
Cependant, les réactions d'hydroamination posent des défis difficiles pour la catalyse : une forte répulsion des électrons de la paire isolée d' atomes d'azote et de la liaison multiple carbone-carbone riche en électrons, associée à des réactions d'hydroamination défavorisées de manière entropique (en particulier la version intermoléculaire), entraîne une grande barrière de réaction . Les problèmes de régiosélectivité entravent également l'utilité synthétique des produits résultants, l'addition de Markovnikov de l'amine étant le résultat le plus courant par rapport à l'addition anti-Markovnikov moins favorisée (voir figure). En conséquence, il existe maintenant de nombreux catalyseurs qui peuvent être utilisés dans l'hydroamination de substrats d'alcènes, d'allènes et d'alcynes, y compris divers catalyseurs hétérogènes à base de métaux, des complexes de métaux de transition précoce (par exemple, le titane et le zirconium), des complexes de métaux de transition tardive (par exemple le ruthénium et le palladium), les complexes de lanthanides et d'actinides (par exemple le samarium et le lanthane), ainsi que les acides et bases de Brønsted.
Catalyseurs
Il a été rapporté que de nombreuses combinaisons métal-ligand catalysent l'hydroamination, y compris les principaux éléments du groupe, notamment les métaux alcalins tels que le lithium , les métaux du groupe 2 tels que le calcium , ainsi que les métaux du groupe 3 tels que l' aluminium , l' indium et le bismuth . En plus de ces exemples de groupes principaux, des recherches approfondies ont été menées sur les métaux de transition avec des rapports sur les métaux précoces, moyens et tardifs, ainsi que sur les éléments des premier, deuxième et troisième rangs. Enfin, les lanthanides ont fait l'objet d'études approfondies. Les zéolites ont également montré leur utilité dans l'hydroamination.
Cycles catalytiques
Le mécanisme de l'hydroamination catalysée par un métal a été bien étudié. L'hydroamination intramoléculaire catalysée par des organolanthanides des alcènes est particulièrement bien étudiée. Tout d'abord, le catalyseur est activé par échange d'amide, générant le catalyseur actif (i). Ensuite, l'alcène s'insère dans la liaison Ln-N (ii). Enfin, la protonolyse se produit en générant le produit cyclisé tout en régénérant également le catalyseur actif (iii). Bien que ce mécanisme illustre l'utilisation d'un catalyseur de lanthanide, il constitue la base des catalyseurs à base de terres rares, d' actinides et de métaux alcalins .
Les catalyseurs d'hydroamination de métaux de transition tardive ont plusieurs modèles basés sur l'étape de détermination régiosélective. Les quatre catégories principales sont (1) l' attaque nucléophile sur un alcène alcyne, ou un ligand allyle et (2) l'insertion de l'alcène dans la liaison métal-amide. Les cycles catalytiques génériques apparaissent ci-dessous. Les mécanismes sont étayés par des études de taux , le marquage isotopique et le piégeage des intermédiaires proposés.
Thermodynamique et cinétique
La réaction d'hydroamination est approximativement thermochimiquement neutre. La réaction souffre cependant d'une barrière d'activation élevée , peut-être en raison de la répulsion du substrat riche en électrons et de l'amine nucléophile . La réaction intermoléculaire s'accompagne également d'un changement d' entropie très négatif , ce qui la rend défavorable à des températures plus élevées.
Par conséquent, des catalyseurs sont nécessaires pour que cette réaction se déroule. Comme d'habitude en chimie, les processus intramoléculaires se produisent à des vitesses plus rapides que les versions intermoléculaires.
Produit thermodynamique vs produit cinétique
En général, la plupart des catalyseurs d'hydroamination nécessitent des températures élevées pour fonctionner efficacement, et en tant que tel, seul le produit thermodynamique est observé. L'isolement et la caractérisation du produit allylamine cinétique plus rare et plus précieux sur le plan synthétique ont été rapportés lorsque des allènes ont été utilisés sur le substrat insaturé. Un système utilisait des températures de 80 °C avec un catalyseur au rhodium et des dérivés d' aniline comme amine. L'autre système rapporté utilisait un catalyseur au palladium à température ambiante avec une large gamme d'amines cycliques et acycliques primaires et secondaires. Les deux systèmes ont produit les amines allyliques souhaitées avec un rendement élevé, qui contiennent un alcène qui peut être davantage fonctionnalisé par des réactions organiques traditionnelles.
Base d'hydroamination catalysée
Les bases fortes catalysent l'hydroamination, un exemple étant l' éthylation de la pipéridine à l' aide d' éthène :
De telles réactions catalysées par une base se déroulent bien avec l'éthène, mais les alcènes supérieurs sont moins réactifs.
Hydroamination catalysée par des complexes du groupe (IV)
Certains complexes de titane et de zirconium catalysent l'hydroamination intermoléculaire des alcynes et des allènes. Les variantes stoechiométriques et catalytiques ont été initialement examinées avec des complexes zirconocène bis(amido). Les complexes titocène amido et sulfonamido catalysent l'hydroamination intramoléculaire des aminoalcènes via une cycloaddition [2+2] qui forme l'azametallacyclobutane correspondant, comme illustré dans la figure ci-dessous. La protonolyse subséquente par le substrat entrant donne le produit α-vinyl-pyrrolidine ( 1 ) ou tétrahydropyridine ( 2 ). Des preuves expérimentales et théoriques soutiennent l'intermédiaire imido proposé et le mécanisme avec des catalyseurs neutres du groupe IV.
Hydroamination formelle
L'addition d'hydrogène et d'un groupe amino (NR 2 ) à l'aide de réactifs autres que l'amine HNR 2 est connue sous le nom de réaction d'"hydroamination formelle". Bien que les avantages de l'économie d'atomes et/ou de la disponibilité immédiate de la source d'azote soient diminués en conséquence, la plus grande force d'entraînement thermodynamique, ainsi que la capacité d'ajuster le réactif d'amination sont potentiellement utiles. A la place de l'amine, des esters d'hydroxylamine et des nitroarènes ont été signalés comme sources d'azote.
Applications
L'hydroamination pourrait trouver des applications en raison de la nature précieuse de l'amine résultante, ainsi que de la verdeur du processus. Les allylamines fonctionnalisées , qui peuvent être produites par hydroamination, ont une application pharmaceutique étendue, bien qu'actuellement de telles espèces ne soient pas préparées par hydroamination. L'hydroamination a été utilisée pour synthétiser l'allylamine Cinnarizine avec un rendement quantitatif. Traite cinnarizine tant de vertige et de mouvement connexes nausées .
L'hydroamination est également prometteuse pour la synthèse d' alcaloïdes . Un exemple était l'étape d'hydroamination utilisée dans la synthèse totale de (-)-épimyrtine.
Voir également
- Ammoxydation - réaction de l'ammoniac avec des alcènes pour donner des nitriles
- Hydroboration
- Hydrosilylation
- (Oléfine) Hydratation
- Hydrofonctionnalisation
Les références
![]() Cet article incorpore un texte de David Michael Barber disponible sous la licence CC BY 2.5 .
Cet article incorpore un texte de David Michael Barber disponible sous la licence CC BY 2.5 .