Histidine décarboxylase - Histidine decarboxylase
| Histidine décarboxylase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
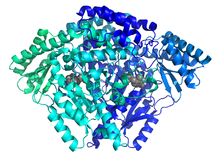 Représentation de bande dessinée d'un dimère HDC tronqué en C avec PLP résidant dans le site actif.
| |||||||||
| Identifiants | |||||||||
| CE n° | 4.1.1.22 | ||||||||
| N ° CAS. | 9024-61-7 | ||||||||
| Bases de données | |||||||||
| IntEnz | Vue IntEnz | ||||||||
| BRENDA | Entrée BRENDA | ||||||||
| ExPASy | Vue NiceZyme | ||||||||
| KEGG | Entrée KEGG | ||||||||
| MétaCycle | voie métabolique | ||||||||
| PRIAM | profil | ||||||||
| Structures de l' APB | RCSB PDB PDBe PDBsum | ||||||||
| Ontologie des gènes | AmiGO / QuickGO | ||||||||
| |||||||||
L'histidine décarboxylase ( HDC ) est une enzyme responsable de la catalyse de la décarboxylation de l' histidine pour former l' histamine . Chez les mammifères, l'histamine est une amine biogène importante avec des rôles régulateurs dans la neurotransmission , la sécrétion d' acide gastrique et la réponse immunitaire . L'histidine décarboxylase est le seul membre de la voie de synthèse de l'histamine , produisant de l'histamine dans une réaction en une étape. L'histamine ne peut être générée par aucune autre enzyme connue. L'HDC est donc la principale source d'histamine chez la plupart des mammifères et des eucaryotes . L'enzyme utilise un cofacteur pyridoxal 5'-phosphate (PLP), similaire à de nombreuses décarboxylases d' acides aminés . Les eucaryotes, ainsi que les bactéries gram-négatives partagent un HDC commun, tandis que les bactéries gram-positives utilisent un HDC dépendant du pyruvoyl sans rapport avec l' évolution . Chez l'homme, l'histidine décarboxylase est codée par le gène HDC .
Structure

L'histidine décarboxylase est une décarboxylase dépendante du pyridoxal du groupe II , ainsi que la décarboxylase aromatique-L-amino-acide et la tyrosine décarboxylase . La HDC est exprimée sous la forme d'un polypeptide de 74 kDa qui n'est pas fonctionnel du point de vue enzymatique. Ce n'est qu'après le traitement post-traductionnel que l'enzyme devient active. Ce traitement consiste à tronquer une grande partie de la chaîne C-terminale de la protéine , réduisant le poids moléculaire du peptide à 54 kDa.
L' histidine décarboxylase existe sous forme d' homodimère , avec plusieurs acides aminés de la chaîne opposée respective stabilisant le site actif de la HDC . À l'état de repos de HDC, le PLP est lié de manière covalente dans une base de Schiff à la lysine 305, et stabilisé par plusieurs liaisons hydrogène aux acides aminés voisins aspartate 273, sérine 151 et sérine 354 de la chaîne opposée. HDC contient plusieurs régions qui sont séquentiellement et structurellement similaires à ceux d'un certain nombre d'autres décarboxylases dépendantes du pyridoxal. Ceci est particulièrement évident au voisinage du site actif lysine 305.
Mécanisme
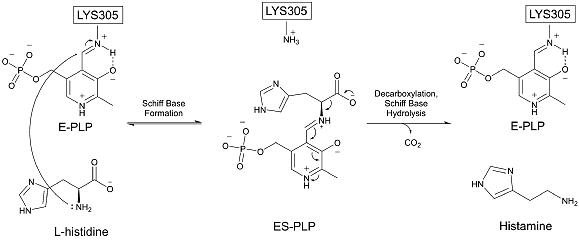
HDC décarboxyle l'histidine grâce à l'utilisation d'un cofacteur PLP initialement lié dans une base de Schiff à la lysine 305. L'histidine initie la réaction en déplaçant la lysine 305 et en formant une aldimine avec le PLP. Ensuite, le groupe carboxyle de l'histidine quitte le substrat, formant du dioxyde de carbone . Il s'agit de l'étape limitante de l'ensemble du processus, nécessitant une énergie d'activation de 17,6 kcal/mol et correspondant au chiffre d'affaires expérimental de 1,73 . Après la décarboxylation, l'intermédiaire PLP est protoné par la tyrosine 334 de la deuxième sous-unité. La protonation est médiée par une molécule d'eau et elle est très rapide et aussi très exergonique. Enfin, le PLP reforme sa base de Schiff d'origine en lysine 305 et l'histamine est libérée. Ce mécanisme est très similaire à ceux employés par d'autres décarboxylases dépendantes du pyridoxal. En particulier, l'intermédiaire aldimine est une caractéristique commune de toutes les décarboxylases PLP-dépendantes connues. HDC est hautement spécifique pour son substrat histidine.
Pertinence biologique
L'histidine décarboxylase est la principale source biologique d'histamine. L'histamine est une amine biogène importante qui modère de nombreux processus physiologiques. Il existe quatre récepteurs d' histamine différents , H 1 , H 2 , H 3 et H 4 , chacun ayant une signification biologique différente. H 1 module plusieurs fonctions du système nerveux central et périphérique , dont le rythme circadien , la température corporelle et l' appétit . L' activation de H 2 entraîne une sécrétion d' acide gastrique et une relaxation des muscles lisses . H 3 contrôles par l' histamine rotation rétro - inhibition de l' histamine synthèse et de la libération. Enfin, H 4 joue un rôle dans la chimiotaxie des mastocytes et la production de cytokines .
Chez l'homme, la HDC est principalement exprimée dans les mastocytes et les granulocytes basophiles . En conséquence, ces cellules contiennent les concentrations les plus élevées de l'organisme en granules d' histamine . L'histamine non mastocytaire se trouve également dans le cerveau , où elle est utilisée comme neurotransmetteur .
Inhibition
La HDC peut être inhibée par l'-fluorométhylhistidine et l'ester méthylique d'histidine .
Signification clinique
Les antihistaminiques sont une classe de médicaments conçus pour réduire les effets indésirables de l'histamine dans le corps. Les antihistaminiques typiques bloquent des récepteurs d'histamine spécifiques , en fonction de l'objectif physiologique qu'ils servent. Par exemple, la diphenhydramine ( Benadryl ™), cible et inhibe le récepteur H1 de l'histamine pour soulager les symptômes des réactions allergiques . Les inhibiteurs de l'histidine décarboxylase peuvent être utilisés en tant qu'antihistaminiques atypiques . Il a été démontré que la tritoqualine , ainsi que diverses catéchines , telles que l' épigallocatéchine-3-gallate , un composant majeur du thé vert , ciblent les cellules HDC et productrices d'histamine, réduisant les niveaux d'histamine et fournissant des propriétés anti-inflammatoires , antitumorales et anti -effets angiogéniques .
Des mutations dans le gène de l'histidine décarboxylase ont été observées dans une famille atteinte du syndrome de Gilles de la Tourette (TS) et ne sont pas considérées comme responsables de la plupart des cas de TS.
Voir également
- L-aminoacide décarboxylase aromatique
- Tyrosine décarboxylase
- Décarboxylation
- Histamine
- Antihistamine
- Pyridoxal 5'-phosphate
- mastocyte
Les références
Lectures complémentaires
- Besoin d'AC, Keefe RS, Ge D, Grossman I, Dickson S, McEvoy JP, Goldstein DB (juillet 2009). « Pharmacogénétique de la réponse antipsychotique dans l'essai CATIE : une analyse de gène candidat » . Journal Européen de Génétique Humaine . 17 (7) : 946-57. doi : 10.1038/ejhg.2008.264 . PMC 2986499 . PMID 19156168 .
- Masini E, Fabbroni V, Giannini L, Vannacci A, Messerini L, Perna F, Cortesini C, Cianchi F (avril 2005). "Histamine et histidine décarboxylase régulation positive dans le cancer colorectal: corrélation avec le stade tumoral" (PDF) . Recherche sur l'inflammation . 54 Suppl 1 : S80-1. doi : 10.1007/s00011-004-0437-3 . hdl : 2158/762726 . PMID 15928846 . S2CID 28682686 .
- Li Z, Liu J, Tang F, Liu Y, Waldum HL, Cui G (décembre 2008). « Expression de l'histidine décarboxylase non mastocytaire dans les microvaisseaux associés aux tumeurs dans les carcinomes épidermoïdes de l'œsophage humain ». APMIS . 116 (12) : 1034–42. doi : 10.1111/j.1600-0463.2008.01048.x . PMID 19133005 . S2CID 19980875 .
- Szafranski K, Schindler S, Taudien S, Hiller M, Huse K, Jahn N, Schreiber S, Backofen R, Platzer M (2007). « Violation des règles d'épissage : les dinucléotides TG fonctionnent comme des sites d'épissage 3' alternatifs dans les introns dépendants de U2 » . Biologie du génome . 8 (8) : R154. doi : 10.1186/gb-2007-8-8-r154 . PMC 2374985 . PMID 17672918 .
- Ai W, Liu Y, Langlois M, Wang TC (mars 2004). "Kruppel-like factor 4 (KLF4) réprime l'expression du gène de l'histidine décarboxylase via un site Sp1 en amont et des éléments sensibles à la gastrine en aval" . Le Journal de Chimie Biologique . 279 (10) : 8684-93. doi : 10.1074/jbc.M308278200 . PMID 14670968 .
- Raychowdhury R, Fleming JV, McLaughlin JT, Bulitta CJ, Wang TC (octobre 2002). « Identification et caractérisation d'un troisième élément de réponse de la gastrine (GAS-RE3) dans le promoteur du gène de l'histidine décarboxylase humaine ». Communications de recherche biochimique et biophysique . 297 (5) : 1089-1095. doi : 10.1016/S0006-291X(02)02345-8 . PMID 12372397 .
- Kimura K, Wakamatsu A, Suzuki Y, Ota T, Nishikawa T, Yamashita R, Yamamoto J, Sekine M, Tsuritani K, Wakaguri H, Ishii S, Sugiyama T, Saito K, Isono Y, Irie R, Kushida N, Yoneyama T , Otsuka R, Kanda K, Yokoi T, Kondo H, Wagatsuma M, Murakawa K, Ishida S, Ishibashi T, Takahashi-Fujii A, Tanase T, Nagai K, Kikuchi H, Nakai K, Isogai T, Sugano S (janvier 2006 ). « Diversification de la modulation transcriptionnelle : identification et caractérisation à grande échelle de promoteurs alternatifs putatifs de gènes humains » . Recherche sur le génome . 16 (1) : 55-65. doi : 10.1101/gr.4039406 . PMC 1356129 . PMID 16344560 .
- Sköldberg F, Portela-Gomes GM, Grimelius L, Nilsson G, Perheentupa J, Betterle C, Husebye ES, Gustafsson J, Rönnblom A, Rorsman F, Kämpe O (avril 2003). « L'histidine décarboxylase, une enzyme dépendante du phosphate de pyridoxal, est un autoantigène des cellules gastriques de type entérochromaffine » . Le Journal d'endocrinologie clinique et du métabolisme . 88 (4) : 1445-1452. doi : 10.1210/jc.2002-021761 . PMID 12679420 .
- Brew O, Lakasing L, Sullivan M (2007). « Activité différentielle de l'histidine décarboxylase dans les placentae normaux et pré-éclamptiques ». Placenta . 28 (5–6) : 585–7. doi : 10.1016/j.placenta.2006.05.003 . PMID 16822545 .
- Zhang F, Xiong DH, Wang W, Shen H, Xiao P, Yang F, Recker RR, Deng HW (octobre 2006). "Les polymorphismes du gène HDC sont associés à l'âge à la ménopause naturelle chez les femmes de race blanche" . Communications de recherche biochimique et biophysique . 348 (4) : 1378-1382. doi : 10.1016/j.bbrc.2006.08.08 . PMC 1803761 . PMID 16919600 .
- Tippens AS, Gruetter CA (juin 2004). « Détection de l'ARNm de l'histidine décarboxylase dans le muscle lisse vasculaire humain et les cellules endothéliales ». Recherche sur l'inflammation . 53 (6) : 215-6. doi : 10.1007/s00011-004-1252-6 . PMID 15167966 .
- Siezen CL, Bont L, Hodemaekers HM, Ermers MJ, Doornbos G, Van't Slot R, Wijmenga C, Houwelingen HC, Kimpen JL, Kimman TG, Hoebee B, Janssen R (avril 2009). « La susceptibilité génétique à la bronchiolite à virus respiratoire syncytial chez les enfants prématurés est associée à des gènes de remodelage des voies respiratoires et à des gènes immunitaires innés ». Le Journal des maladies infectieuses pédiatriques . 28 (4) : 333-5. doi : 10.1097/INF.0b013e31818e2aa9 . PMID 19258923 . S2CID 25601837 .
- Morgan TK, Montgomery K, Mason V, West RB, Wang L, van de Rijn M, Higgins JP (juillet 2006). « Régulation à la hausse de l'expression de l'histidine décarboxylase dans les néphrons corticaux superficiels pendant la grossesse chez la souris et la femme » . Rein International . 70 (2) : 306-14. doi : 10.1038/sj.ki.5001553 . PMID 16760908 .
- Papadopoulou N, Kalogeromitros D, Staurianeas NG, Tiblalexi D, Theoharides TC (novembre 2005). "Expression du récepteur-1 de l'hormone de libération de la corticotrophine et de l'histidine décarboxylase dans l'urticaire chronique" . Le Journal de la dermatologie d'investigation . 125 (5) : 952-5. doi : 10.1111/j.0022-202X.2005.23913.x . PMID 16297195 .
- Janssen R, Bont L, Siezen CL, Hodemaekers HM, Ermers MJ, Doornbos G, van 't Slot R, Wijmenga C, Goeman JJ, Kimpen JL, van Houwelingen HC, Kimman TG, Hoebee B (septembre 2007). « La susceptibilité génétique à la bronchiolite à virus respiratoire syncytial est principalement associée aux gènes immunitaires innés ». Le Journal des maladies infectieuses . 196 (6) : 826–34. doi : 10.1086/520886 . PMID 17703412 .
- Strausberg RL, Feingold EA, Grouse LH, Derge JG, Klausner RD, Collins FS, et al. (décembre 2002). "Génération et analyse initiale de plus de 15 000 séquences d'ADNc humaines et de souris pleine longueur" . Actes de l'Académie nationale des sciences des États-Unis d'Amérique . 99 (26) : 16899–903. Bibcode : 2002PNAS ... 9916899M . doi : 10.1073/pnas.242603899 . PMC 139241 . PMID 12477932 .
- Aichberger KJ, Mayerhofer M, Vales A, Krauth MT, Gleixner KV, Bilban M, Esterbauer H, Sonneck K, Florian S, Derdak S, Pickl WF, Agis H, Falus A, Sillaber C, Valent P (novembre 2006). "L'oncoprotéine BCR/ABL liée à la LMC induit l'expression de l'histidine décarboxylase (HDC) et la synthèse d'histamine dans les cellules leucémiques" . Du sang . 108 (10) : 3538–47. doi : 10.1182/sang-2005-12-028456 . PMID 16849647 .
- Lee JK, Kim HT, Cho SM, Kim KH, Jin HJ, Ryu GM, Oh B, Park C, Kimm K, Jo SA, Jung SC, Kim S, In SM, Lee JE, Jo I (2003). "Caractérisation de 458 polymorphismes nucléotidiques simples de gènes candidats à la maladie dans la population coréenne" . Journal de génétique humaine . 48 (5) : 213-6. doi : 10.1007/s10038-003-0011-9 . PMID 12768436 .
- Jeong HJ, Moon PD, Kim SJ, Seo JU, Kang TH, Kim JJ, Kang IC, Um JY, Kim HM, Hong SH (avril 2009). « L'activation du facteur 1 inductible par l'hypoxie régule l'expression de l'histidine décarboxylase humaine ». Sciences de la vie cellulaire et moléculaire . 66 (7) : 1309–19. doi : 10.1007/s00018-009-9001-1 . PMID 19266161 . S2CID 23800803 .
Liens externes
- Histidine+Décarboxylase dans les vedettes-matières médicales de la National Library of Medicine des États-Unis (MeSH)
Cet article incorpore du texte de la National Library of Medicine des États-Unis , qui est dans le domaine public .

