Métallothionéine - Metallothionein
| Superfamille des métallothionéines (plante) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||
| Identifiants | |||||||||||
| symbole | Metallothionein_sfam | ||||||||||
| Pfam | PF00131 | ||||||||||
| InterPro | IPR003019 | ||||||||||
| |||||||||||
| Levure MT | |||||||||
|---|---|---|---|---|---|---|---|---|---|

La métallothionéine de Saccharomyces cerevisiae MT liée aux ions cuivre . Cystéines en jaune, cuivre en marron. ( APD : 1AQS )
| |||||||||
| Identifiants | |||||||||
| symbole | Métallothionéine de levure | ||||||||
| Pfam | PF11403 | ||||||||
| Clan Pfam | CL0461 | ||||||||
| InterPro | IPR022710 | ||||||||
| |||||||||
| SmtA cyanobactérien | |||||||||
|---|---|---|---|---|---|---|---|---|---|
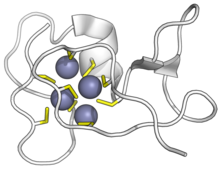
Métallothionéine cyanobactérienne SmtA liée aux ions zinc. Cystéines en jaune, zinc en violet. ( APD : 1JJD )
| |||||||||
| Identifiants | |||||||||
| symbole | Métallothionéine bactérienne | ||||||||
| Pfam | PF02069 | ||||||||
| Clan Pfam | CL0461 | ||||||||
| InterPro | IPR000518 | ||||||||
| |||||||||
Métallothionéine (MT) est une famille de cystéine riche, à faible poids moléculaire (PM allant de 500 à 14000 Da ) des protéines . Ils sont localisés à la membrane de l'appareil de Golgi . Les MT ont la capacité de lier à la fois les métaux lourds physiologiques (tels que le zinc , le cuivre , le sélénium ) et xénobiotiques (tels que le cadmium , le mercure , l' argent , l' arsenic ) par le biais du groupe thiol de ses résidus cystéine, qui représentent près de 30% de ses acides aminés constitutifs. résidus acides .
La MT a été découverte en 1957 par Vallée et Margoshe à partir de la purification d'une protéine de liaison au Cd du cortex rénal de cheval (équin) . La MT joue un rôle dans la protection contre la toxicité des métaux et le stress oxydatif , et est impliquée dans la régulation du zinc et du cuivre. Il existe quatre isoformes principales exprimées chez l'homme (famille 1, voir tableau ci-dessous) : MT1 (sous-types A , B , E , F , G , H , L , M , X ), MT2 , MT3 et MT4 . Dans le corps humain, de grandes quantités sont synthétisées principalement dans le foie et les reins . Leur production dépend de la disponibilité des minéraux alimentaires tels que le zinc , le cuivre et le sélénium , ainsi que les acides aminés histidine et cystéine.
Les métallothionéines sont riches en thiols, ce qui les oblige à se lier à un certain nombre de métaux traces. La métallothionéine lie plusieurs ions Zn. L'une des rares protéines eucaryotes à se distinguer comme ayant un rôle dans la détoxification substantielle des métaux. Le zinc et le cadmium sont tétraédriquement coordonnés aux résidus cystéine, chaque molécule de protéine métallothionéine peut lier jusqu'à 7 atomes de Zn ou de Cd. La biosynthèse de la métallothionéine semble avoir augmenté de plusieurs fois tout au long du stress oxydatif pour protéger les cellules contre la cytotoxicité et les dommages à l'ADN. La biosynthèse des métallothionéines peut également être induite par certains agents ou conditions, par exemple, les hormones, les produits pharmaceutiques, les alcools, d'autres traitements de substances et bien d'autres. La métallothionéine est une protéine cytoplasmique, dans un foie adulte, elle est localisée principalement dans le cytoplasme. Chez le fœtus humain, la métallothionéine est localisée dans les noyaux des hépatocytes.
Structure et classement
Les MT sont présentes dans une vaste gamme de groupes taxonomiques, allant des procaryotes (comme les cyanobactéries Synechococcus sp. ), des protozoaires (comme les genres ciliés Tetrahymena ), des plantes (comme Pisum sativum , Triticum durum , Zea mays ou Quercus suber ), des levures (telles que Saccharomyces cerevisiae ou Candida albicans ), des invertébrés (tels que les nématodes Caenorhabditis elegans , l'insecte Drosophila melanogaster , le mollusque Mytilus edulis , ou le échinoderme Strongylocentrotus purpuratus ) et de vertébrés ( par exemple le poulet Gallus gallus , ou la mammifère Homo sapiens ou Mus musculus ).
Les MT de cette gamme taxonomique diversifiée représentent une séquence à haute hétérogénéité (en ce qui concerne le poids moléculaire et le nombre et la distribution des résidus Cys) et ne présentent pas d'homologie générale ; malgré cela, une homologie est trouvée à l'intérieur de certains groupes taxonomiques (tels que les vertébrés MT).
A partir de leur structure primaire , les MT ont été classés par différentes méthodes. La première date de 1987, lorsque Fowler et al. , a établi trois classes de MT : la classe I, y compris les MT qui présentent une homologie avec la MT du cheval, la classe II, y compris le reste des MT sans homologie avec la MT du cheval, et la classe III, qui comprend les phytochélatines , les peptides synthétisés enzymatiquement riches en Cys . La deuxième classification a été réalisée par Binz et Kagi en 2001, et prend en compte les paramètres taxonomiques et les schémas de distribution des résidus Cys le long de la séquence MT. Il aboutit à une classification de 15 familles de MT protéiques. La famille 15 contient les plantes MT, qui en 2002 ont été classées par Cobbet et Goldsbrough en 4 types (1, 2, 3 et 4) en fonction de la distribution de leurs résidus Cys et des régions dépourvues de Cys (appelées espaceurs) caractéristiques de planter des MT.
Un tableau reprenant les principaux aspects de ces deux dernières classifications est inclus.
| Famille | Nom | Modèle de séquence | Exemple |
|---|---|---|---|
| 1 | Vertébré | Kx(1,2)-CCxCCPx(2)-C |
Mus musculus MT1 MDPNCSCTTGGSCACAGSCKCKECKCTSCKKCCSCPCPVGCAKCAQGCVCKGSSEKCRCCA |
| 2 | Mollusque | CxCx(3)-CTGx(3)-CxCx(3)-CxCK |
Mytilus edulis 10MTIV MPAPCNCIETNVCICDTGCSGEGCRCGDACKCSGADCKCSGCKVVCKCSGSCACEGGCTGPSTCKCAPGCSCK |
| 3 | Crustacé | P-[GD]-PCCx(3,4)-CxC |
Homarus americanus MTH MPGPCCKDKCECAEGGCKTGCKCTSCRCAPCEKCTSGCKCPSKDECAKTCSKPCKCCP |
| 4 | Échinodermes | PDxKCVCCx(5)-CxCx(4)-CCx(4)-CCx(4,6)-CC |
Strongylocentrotus purpuratus SpMTA MPDVKCVCCKEGKECACFGQDCCKTGECCKDGTCCGICTNAACKCANGCKCGSGCSCTEGNCAC |
| 5 | Diptères | CGx(2)-CxCx(2)-Qx(5)-CxCx(2)DCxC |
Drosophila melanogaster MTNB MVCKGCGTNCQCSAQKCGDNCACNKDCQCVCKNGPKDQCCSNK |
| 6 | Nématode | KCCx(3)-CC |
Caenorhabditis elegans MT1 MACKCDCKNKQCKCGDKCECSGDKCCEKYCCEEASEKKCCPAGCKGDCKCANCHCAEQKQCGDKTHQHQGTAAAH |
| 7 | Cilié | xCCCx ? |
Tetrahymena thermophila MTT1 MDKVNSCCCGVNAKPCCTDPNSGCCCVSKTDNCCKSDTKECCTGTGEGCKCVNCKCCKPQANCCCGVNAKPCCFDPNSGCCCVSKTNNCCKSD TKECCTGTGEGCKCTSCQCCKPVQQGCCCGDKAKACCTDPNSGCCCSNKANKQCCDATSKQ |
| 8 | Champignon 1 | CGCSx(4)-CxCx(3,4)-CxCSxC |
Neurospora crassa MT MGDCGCSGASSCNCGSGCSCSNCGSK |
| 9 | Champignon 2 | --- |
Candida glabrata MT2 MANDCKCPNGCSCPNCANGGCQCGDKCECKKQSCHGCGEQCKCGSHGSSCHGSCGCGDKCECK |
| dix | fongique 3 | --- |
Candida glabrata MT2 MPEQVNCQYDCHCSNCACENTCNCCAKPACACTNSASNECSCQTCKCQTCKC |
| 11 | fongique 4 | CXKCxCx(2)-CKC |
Yarrowia lipolytica MT3 MEFTTAMLGASLISTTSTQSKHNLVNNCCCSSSTSESSMPASCACTKCGCKTCKC |
| 12 | Champignon 5 | --- |
Saccharomyces cerevisiae CUP1 MFSELINFQNEGHECQCQCGSCKNNEQCQKSCSCPTGCNSDDKCPCGNKSEETKKSCCSGK |
| 13 | Champignon 6 | --- |
Saccharomyces cerevisiae CRS5 TVKICDCEGECCKDSCHCGSTCLPSCSGGEKCKCDHSTGSPQCKSCGEKCKCETTCTCEKSKCNCEKC |
| 14 | Procaryote | KCACx(2)-CLC |
Synechococcus sp SmtA MTTVTQMKCACPHCLCIVSLNDAIMVDGKPYCSEVCANGTCKENSGCGHAGCGCGSA |
| 15 | Plante | [YFH]-x(5,25)-C-[SKD]-C-[GA]-[SDPAT]-x(0,1)-Cx-[CYF] | |
| 15.1 | Usine MTs Type 1 | CXCX(3)- CXCX(3)- CXCX(3)-entretoise-CXCX(3)- CXCX(3)- CXCX(3) |
Pisum sativum MT MSGCGCGSSCNCGDSCKCNKRSSGLSYSEMETTETVILGVGPAKIQFEGAEMSAASEDGGCKCGDNCTCDPCNCK |
| 15.2 | Usine MTs Type 2 | CCX(3)-CXCX(3)- CXCX(3)- CXCX(3)-entretoise- CXCX(3)- CXCX(3)- CXCX(3) |
Lycopersicon esculentum MT MSCCGGNCGCGSSCKCGNGCGGCKMYPDMSYTESSTTTETLVLGVGPEKTSFGAMEMGESPVAENGCKCGSDCKCNPCTCSK |
| 15.3 | Usine MTs Type 3 | --- |
Arabidopsis thaliana MT3 MSSNCGSCDCADKTQCVKKGTSYTFDIVETQESYKEAMIMDVGAEENNANCKCKCGSSCSCVNCTCCPN |
| 15,4 | Usine MTs Type 4 ou Ec | Cx(4)-CXCX(3)-CX(5)-CXCX(9,11)-HTTCGCGEHC-
XCX(20)-CSCGAXCNCASC-X(3,5) |
Triticum aestivum MT MGCNDKCGCAVPCPGGTGCRCTSARSDAAAGEHTTCGCGEHCGCNPCACGREGTPSGRANRRANCSCGAACNCASCGSTTA |
| 99 | Phytochélatines et autres polypeptides non protéiniques de type MT | --- |
Schizosaccharomyces pombe EC-γEC-γECG |
Plus de données sur cette classification sont à découvrir sur la page Expasy métallothionéine.
Des éléments de structure secondaires ont été observés dans plusieurs MT SmtA de Syneccochoccus , mammifère MT3, Echinoderma SpMTA, poisson Notothenia coriiceps MT, Crustacé MTH, mais jusqu'à présent, le contenu de telles structures est considéré comme pauvre en MT, et son influence fonctionnelle est pas considéré.
La structure tertiaire des MT est également très hétérogène. Alors que les MT de vertébrés, d'échinodermes et de crustacés présentent une structure bidominiale avec des métaux divalents comme le Zn(II) ou le Cd(II) (la protéine est repliée de manière à lier les métaux dans deux domaines fonctionnellement indépendants, avec un cluster métallique chacun), la levure et le procariotyc Les MT présentent une structure monodominiale (un domaine avec un seul cluster métallique ). Bien qu'aucune donnée structurelle ne soit disponible pour les MT des mollusques, des nématodes et des drosophiles, il est communément admis que les premières sont bidominiales et les secondes monodominiales. Aucune donnée concluante n'est disponible pour les MT végétales, mais deux structures possibles ont été proposées : 1) une structure bidominiale similaire à celle des MT vertébrés ; 2) une structure codominiale, dans laquelle deux domaines riches en Cys interagissent pour former un seul amas métallique.
La structure quaternaire n'a pas été largement considérée pour les MT. Les processus de dimérisation et d'oligomérisation ont été observés et attribués à plusieurs mécanismes moléculaires, notamment la formation de disulfure intermoléculaire, le pontage à travers des métaux liés par des résidus Cys ou His sur différentes MT, ou des interactions inorganiques médiées par les phosphates. Il a été démontré que les MT dimères et polymères acquièrent de nouvelles propriétés lors de la détoxification des métaux, mais la signification physiologique de ces processus n'a été démontrée que dans le cas du Synechococcus SmtA procaryote. Le dimère MT produit par cet organisme forme des structures similaires aux doigts de zinc et possède une activité régulatrice du Zn.
Les métallothionéines ont diverses préférences de liaison aux métaux, qui ont été associées à une spécificité fonctionnelle. A titre d'exemple, le mammifère Mus musculus MT1 se lie préférentiellement aux ions métalliques divalents (Zn(II), Cd(II),...), tandis que la levure CUP1 est sélective pour les ions métalliques monovalents (Cu(I), Ag(I), ...). Ont été découverts strictement MTs métal sélectif avec des fonctions physiologiques spécifiques à métal par Dallinger et al. (1997) chez des escargots pulmonés (Gastropoda, Mollusca). L'escargot romain ( Helix pomatia ), par exemple, possède une isoforme sélective pour le Cd (CdMT) et une isoforme sélective pour le Cu (CuMT) impliquées respectivement dans la détoxification du Cd et la régulation du Cu. Alors que les deux isoformes contiennent des nombres et des positions invariables de résidus Cys responsables de la ligature des métaux, la sélectivité des métaux est apparemment obtenue par modulation de séquence des résidus d'acides aminés non directement impliqués dans la liaison aux métaux (Palacios et al. 2011).
Une nouvelle classification fonctionnelle des MT en tant que Zn- ou Cu-thionéines est actuellement en cours de développement sur la base de ces préférences fonctionnelles.
Levure
Les métallothionéines sont caractérisées par une abondance de résidus cystéine et un manque de motifs génériques de structure secondaire . La métallothionéine de levure (MT) est également appelée métallothionéine de cuivre (CUP). La métallothionéine de levure se coordonne beaucoup plus fortement à Cu + qu'à Cu 2+ .
Fonction
Cette protéine fonctionne dans le stockage, le transport et la détoxification primaires des métaux . Plus précisément, Yeast MT stocke le cuivre et protège donc la cellule contre la toxicité du cuivre en chélatant étroitement les ions cuivre.
Pour les 40 premiers résidus de la protéine, le polypeptide s'enroule autour du métal en formant deux grandes boucles parallèles séparées par une fente profonde contenant le groupe métallique.
Exemples
La levure MT peut être trouvée dans les éléments suivants :
- Saccharomyces cerevisiae
- Neurospora crassa
Fonction
Reliure en métal
La métallothionéine a été documentée pour lier un large éventail de métaux, notamment le cadmium, le plomb, le zinc, le mercure, le cuivre, l'arsenic, l'argent, etc. un mécanisme séquentiel et non coopératif. L'observation de MT partiellement métallisées (c'est-à-dire ayant une certaine capacité de liaison aux métaux libres) suggère que ces espèces sont biologiquement importantes.
Les métallothionéines participent probablement à l'absorption, au transport et à la régulation du zinc dans les systèmes biologiques. La MT des mammifères lie trois ions Zn(II) dans son domaine bêta et quatre dans le domaine alpha. La cystéine est un acide aminé soufré, d'où le nom de "-thionéine". Cependant, la participation d'ions sulfure et chlorure inorganiques a été proposée pour certaines formes MT. Dans certaines MT, principalement bactériennes, l'histidine participe à la liaison du zinc. En liant et en libérant le zinc, les métallothionéines (MT) peuvent réguler les niveaux de zinc dans le corps. Le zinc, à son tour, est un élément clé pour l'activation et la liaison de certains facteurs de transcription par sa participation dans la région à doigt de zinc de la protéine. La métallothionéine transporte également des ions zinc (signaux) d'une partie de la cellule à une autre. Lorsque le zinc pénètre dans une cellule, il peut être capté par la thionéine (qui devient ainsi « métallothionéine ») et transporté vers une autre partie de la cellule où il est libéré vers un autre organite ou une autre protéine. De cette façon, la thionéine et la métallothionéine deviennent un élément clé du système de signalisation du zinc dans les cellules. Ce système est particulièrement important dans le cerveau, où la signalisation du zinc est prédominante à la fois entre et dans les cellules nerveuses. Il semble également être important pour la régulation de la protéine suppresseur de tumeur p53.
Contrôle du stress oxydatif
Les résidus de cystéine des MT peuvent capturer des radicaux oxydants nocifs comme les radicaux superoxyde et hydroxyle. Dans cette réaction, la cystéine est oxydée en cystine et les ions métalliques qui étaient liés à la cystéine sont libérés dans le milieu. Comme expliqué dans la section Expression et régulation , ce Zn peut activer la synthèse de plusieurs MT. Ce mécanisme a été proposé comme étant un mécanisme important dans le contrôle du stress oxydatif par les MT. Le rôle des MT dans la réduction du stress oxydatif a été confirmé par des mutants MT Knockout, mais certaines expériences proposent également un rôle prooxydant pour les MT.
La métallothionéine joue également un rôle dans la différenciation et la prolifération des cellules hématopoïétiques, ainsi que dans la prévention de l'apoptose des cellules différenciées précocement. Les niveaux de MT induits étaient négativement associés à la sensibilité à l'apoptose induite par l'étoposide, ce qui signifie que la MT est un contrôleur négatif potentiel de l'apoptose.
Expression et régulation
L'expression du gène de la métallothionéine est induite par une grande variété de stimuli, comme l'exposition aux métaux, le stress oxydatif, les glucocorticoïdes, la vitamine D , le stress hydrique, le jeûne , l' exercice , etc. Le niveau de réponse à ces inducteurs dépend du gène MT. Les gènes MT présentent dans leurs promoteurs des séquences spécifiques pour la régulation de l'expression, des éléments en tant qu'éléments de réponse métalliques (MRE), des éléments de réponse aux glucocorticoïdes (GRE), des boîtes riches en GC, des éléments de niveau basal (BLE) et des éléments de réponse thyroïdienne (TRE) .
Métallothionéine et maladie
Cancer
Étant donné que les MT jouent un rôle important dans la régulation des facteurs de transcription, des défauts de la fonction ou de l'expression des MT peuvent entraîner une transformation maligne des cellules et, finalement, le cancer . Des études ont trouvé une expression accrue des MT dans certains cancers du sein, du côlon, du rein, du foie, de la peau (mélanome), du poumon, du nasopharynx, des ovaires, de la prostate, de la bouche, des glandes salivaires, des testicules, de la thyroïde et de la vessie ; ils ont également trouvé des niveaux inférieurs d'expression de la MT dans le carcinome hépatocellulaire et l'adénocarcinome du foie.
Il existe des preuves suggérant que des niveaux plus élevés d'expression de la MT peuvent également conduire à une résistance aux médicaments chimiothérapeutiques .
Autisme
La toxicité des métaux lourds a été proposée comme une étiologie hypothétique de l' autisme , et un dysfonctionnement de la synthèse et de l'activité de la MT peut jouer un rôle dans cela. De nombreux métaux lourds, dont le mercure , le plomb et l' arsenic, ont été associés à des symptômes qui ressemblent aux symptômes neurologiques de l'autisme. Cependant, le dysfonctionnement de la MT n'a pas été spécifiquement lié aux troubles du spectre autistique. Une étude de 2006, portant sur des enfants exposés au conservateur du vaccin thiomersal , a révélé que les niveaux de MT et d' anticorps anti- MT chez les enfants autistes ne différaient pas significativement de ceux des enfants non autistes.
Un faible rapport zinc/cuivre a été considéré comme un biomarqueur de l'autisme et suggéré comme une indication que le système métallothionéine a été affecté.
De plus, il y a des indications que les niveaux de zinc de la mère peuvent affecter l'état immunologique du bébé en développement qui peut conduire à l'autisme et pourrait à nouveau être une indication que le système métallothionéine a été affecté.
Voir également
Les références
Lectures complémentaires
- Cherian MG, Jayasurya A, Bay BH (décembre 2003). « Les métallothionéines dans les tumeurs humaines et les rôles potentiels dans la cancérogenèse ». Recherche sur les mutations . 533 (1–2) : 201–9. doi : 10.1016/j.mrfmmm.2003.07.013 . PMID 14643421 .
