Réaction péricyclique - Pericyclic reaction
En chimie organique , une réaction péricyclique est le type de réaction organique dans laquelle l' état de transition de la molécule a une géométrie cyclique, la réaction progresse de manière concertée et les orbitales de liaison impliquées dans la réaction se chevauchent dans un cycle continu à l'état de transition . Les réactions péricycliques s'opposent aux réactions linéaires , englobant la plupart des transformations organiques et passant par un état de transition acyclique, d'une part, et des réactions coarctées , qui passent par un état de transition doublement cyclique et concerté, d'autre part. Les réactions péricycliques sont généralement un réarrangementou des réactions d' addition . Les principales classes de réactions péricycliques sont données dans le tableau ci-dessous (les trois classes les plus importantes sont indiquées en gras). Les réactions ène et les réactions chélétropes sont souvent classées respectivement comme réactions de transfert de groupe et cycloadditions / réversions, tandis que les réactions dyotropes et les réactions de transfert de groupe (si les réactions ène sont exclues) sont rarement rencontrées.
| Nom | Changements d'obligations | |
|---|---|---|
| Sigma | Pi | |
| Réaction électrocyclique | + 1 | - 1 |
| Cycloaddition (et cycloreversion) | + 2 | - 2 |
| Réaction sigmatropique | 0 | 0 |
| Réaction de transfert de groupe | 0 | 0 |
| Réaction Ene | + 1 | - 1 |
| Réaction chélétropique | + 2 | - 1 |
| Réaction Dyotropique | 0 | 0 |
En général, ceux-ci sont considérés comme des processus d'équilibre , bien qu'il soit possible de pousser la réaction dans une direction en concevant une réaction par laquelle le produit est à un niveau d'énergie nettement inférieur; cela est dû à une interprétation unimoléculaire du principe de Le Chatelier . Il existe donc un ensemble de réactions péricycliques «rétro».
Mécanisme de la réaction péricyclique
Par définition, les réactions péricycliques passent par un mécanisme concerté impliquant un seul état de transition cyclique. Pour cette raison, avant une compréhension systématique des processus péricycliques par le principe de la conservation de la symétrie orbitale , ils étaient facétieusement appelés «réactions sans mécanisme». Cependant, les réactions pour lesquelles des mécanismes péricycliques peuvent être dessinés ont souvent des mécanismes par étapes liés procédant par des intermédiaires radicaux ou dipolaires qui sont également viables. Certaines classes de réactions péricycliques, telles que les réactions de cycloaddition [2 + 2] cétène , peuvent être «controversées» car leur mécanisme n'est parfois pas définitivement reconnu comme étant concerté (ou peut dépendre du système réactif). En outre, les réactions péricycliques ont aussi souvent des analogues catalysés par un métal, bien que généralement ceux-ci ne soient pas non plus techniquement péricycliques, puisqu'ils se déroulent via des intermédiaires stabilisés par un métal, et ne sont donc pas concertés.
Malgré ces mises en garde, la compréhension théorique des réactions péricycliques est probablement parmi les plus sophistiquées et les plus développées de toute la chimie organique. La compréhension de la façon dont les orbitales interagissent au cours d'un processus péricyclique a conduit aux règles de Woodward-Hoffmann , un simple ensemble de critères pour prédire si un mécanisme péricyclique pour une réaction est probable ou favorable. Par exemple, ces règles prédisent que la [4 + 2] cycloaddition de butadiène et d'éthylène dans des conditions thermiques est probablement un processus péricyclique, alors que la [2 + 2] cycloaddition de deux molécules d'éthylène ne l'est pas. Ceux-ci sont cohérents avec les données expérimentales, soutenant un état de transition ordonné et concerté pour le premier et un processus radical en plusieurs étapes pour le second. Plusieurs approches équivalentes, décrites ci-dessous, conduisent aux mêmes prédictions.
La théorie de l'état de transition aromatique suppose que l' état de transition énergétique minimum pour un processus péricyclique est aromatique , le choix de la topologie de la réaction étant déterminé par le nombre d'électrons impliqués. Pour les réactions impliquant des systèmes électroniques (4 n + 2) (2, 6, 10, ... électrons; nombre impair de paires d'électrons), des états de transition topologiques de Hückel sont proposés, dans lesquels la partie réactive de la ou des molécules réactives a orbitales interagissant dans un cycle continu avec un nombre pair de nœuds. Dans les systèmes à 4 n électrons (4, 8, 12, ... électrons; nombre pair de paires d'électrons) des états de transition de topologie de Möbius sont proposés, dans lesquels les molécules en réaction ont des orbitales interagissant dans un cycle continu torsadé avec un nombre impair de nœuds . Les états de transition correspondants (4 n + 2) électrons de Möbius et 4 n- électrons de Hückel sont antiaromatiques et sont donc fortement défavorisés. La théorie des états de transition aromatiques aboutit à un énoncé particulièrement simple des règles généralisées de Woodward – Hoffmann: une réaction péricyclique impliquant un nombre impair de paires d'électrons passera par un état de transition de Hückel (nombre pair de composants antarafaciaux dans la terminologie Woodward – Hoffmann), tandis qu'un la réaction péricyclique impliquant un nombre pair de paires d'électrons passera par un état de transition de Möbius (nombre impair de composants antarafaciaux).
De manière équivalente, les réactions péricycliques ont été analysées avec des diagrammes de corrélation , qui suivent l'évolution des orbitales moléculaires (appelées `` corrélant '' les orbitales moléculaires) des molécules en réaction au fur et à mesure qu'elles progressent des réactifs aux produits via un état de transition, en fonction de leurs propriétés de symétrie. . Les réactions sont favorables («autorisées») si l'état fondamental des réactifs est corrélé à l'état fondamental des produits, alors qu'elles sont défavorables («interdites») si l'état fondamental des réactifs est corrélé à un état excité des produits. Cette idée est connue sous le nom de conservation de la symétrie orbitale . La prise en compte des interactions des orbitales moléculaires les plus occupées et les plus basses inoccupées ( analyse orbitale de frontière ) est une autre approche pour analyser l'état de transition d'une réaction péricyclique.
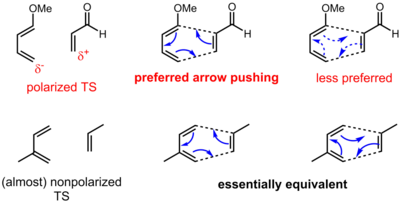
Flèche pour les réactions péricycliques
La convention de poussée de flèche pour les réactions péricycliques a une signification quelque peu différente par rapport aux réactions polaires (et radicalaires). Pour les réactions péricycliques, il n'y a souvent aucun mouvement évident des électrons d'une source riche en électrons vers un puits pauvre en électrons. Au contraire, les électrons sont redistribués autour d'un état de transition cyclique. Ainsi, les électrons peuvent être poussés dans l'une ou l'autre des deux directions pour une réaction péricyclique. Pour certaines réactions péricycliques, cependant, il existe une polarisation définie de la charge à l'état de transition en raison de l'asynchronicité (la formation et la rupture de liaison ne se produisent pas de manière uniforme à l'état de transition). Ainsi, une direction peut être préférée à une autre, bien que l'on puisse soutenir que les deux représentations sont toujours formellement correctes. Dans le cas de la réaction de Diels-Alder ci-dessous, les arguments de résonance indiquent clairement la direction de polarisation. Dans des situations plus complexes, cependant, des calculs détaillés peuvent être nécessaires pour déterminer la direction et l'étendue de la polarisation.
Processus pseudopéricycliques
Les réactions pseudopéricycliques sont étroitement liées aux processus péricycliques . Bien qu'une réaction pseudopéricyclique passe par un état de transition cyclique, deux des orbitales impliquées sont contraintes d'être orthogonales et ne peuvent pas interagir. L'exemple le plus célèbre est peut-être l' hydroboration d'une oléfine . Bien que cela semble être un processus de transfert de groupe interdit par topologie de Hückel à 4 électrons, l'orbitale p vide et la liaison B – H hybridée sp 2 sont orthogonales et n'interagissent pas. Par conséquent, les règles de Woodward-Hoffmann ne s'appliquent pas. (Le fait que l'on pense que l'hydroboration se déroule par complexation π initiale peut également être pertinent.)
En biochimie
Des réactions péricycliques se produisent également dans plusieurs processus biologiques:
- Réarrangement de Claisen du chorismate en préphénate dans presque tous les organismes prototrophes
- [1,5] - changement sigmatropique dans la transformation de la précorrine-8x en acide hydrogénobyrinique
- ouverture de cycle électrocyclique photochimique non enzymatique et changement d'hydrure sigmatropique (1,7) dans la synthèse de la vitamine D
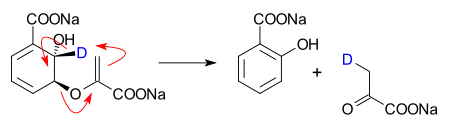
- Isochorismate lyase pyruvate conversion de catalysé isochorismate en salicylate et pyruvate