Plasmodium knowlesi -Plasmodium knowlesi
| Plasmodium knowlesi | |
|---|---|
|
|
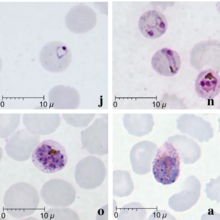
| Frottis colorés au Giemsa de Plasmodium knowlesi infectant des globules rouges humains | |
|
Classement scientifique |
|
| (non classé): | Diaphoretickes |
| Clade : | TSAR |
| Clade : | DAS |
| Infraroyaume : | Alvéolata |
| Phylum: | Apicomplexe |
| Classer: | Aconoidasida |
| Commander: | Haemospororida |
| Famille: | Plasmodiidae |
| Genre: | Plasmodium |
| Espèce: |
P. knowlesi
|
| Nom binomial | |
|
Plasmodium knowlesi Sinton et Mulligan 1932
|
|
Plasmodium knowlesi est un parasite qui cause le paludisme chez l'homme et d'autres primates. On le trouve dans toute l'Asie du Sud-Est et c'est la cause la plus fréquente de paludisme humain en Malaisie . Comme d'autresespèces de Plasmodium , P. knowlesi a un cycle de vie qui nécessite l'infection à la fois d'un moustique et d'un hôte à sang chaud. Alors que les hôtes naturels à sang chaud de P. knowlesi sont probablement divers singes de l'Ancien Monde , les humains peuvent être infectés par P. knowlesi s'ils sont nourris par des moustiques infectés. P. knowlesi est un eucaryote du phylum Apicomplexa , du genre Plasmodium et du sous-genre Plasmodium . Il est le plus étroitement lié au parasite humain Plasmodium vivax ainsi qu'à d'autresespèces de Plasmodium qui infectent les primates non humains.
Les humains infectés par P. knowlesi peuvent développer un paludisme simple ou grave semblable à celui causé par Plasmodium falciparum . Le diagnostic de l' infection à P. knowlesi est difficile car P. knowlesi ressemble de très près à d'autres espèces qui infectent les humains. Le traitement est similaire à d'autres types de paludisme, avec une thérapie combinée à la chloroquine ou à l' artémisinine généralement recommandée. Le paludisme à P. knowlesi est une maladie émergente que l'on croyait rare chez l'homme, mais de plus en plus reconnue comme un fardeau majeur pour la santé en Asie du Sud-Est.
P. knowlesi a été décrit pour la première fois comme une espèce distincte et comme une cause potentielle de paludisme chez l'homme en 1932. Il a été brièvement utilisé au début du 20e siècle pour provoquer de la fièvre comme traitement de la neurosyphilis . Au milieu du 20e siècle, P. knowlesi est devenu populaire en tant qu'outil d'étude de la biologie de Plasmodium et a été utilisé pour la recherche fondamentale, la recherche sur les vaccins et le développement de médicaments. P. knowlesi est toujours utilisé comme modèle de laboratoire pour le paludisme, car il infecte facilement le primate modèle le macaque rhésus et peut être cultivé en culture cellulaire dans du sang humain ou macaque.
Cycle de la vie
Comme d'autres parasites Plasmodium , P. knowlesi a un cycle de vie qui nécessite un va-et-vient entre les hôtes mammifères et les insectes hôtes. Les primates sont infectés par la piqûre d'un moustique anophèle infecté qui porte un stade parasite appelé sporozoïte dans ses glandes salivaires. Les sporozoïtes suivent la circulation sanguine jusqu'au foie des primates où ils se développent et se répliquent pendant cinq à six jours avant d'éclater, libérant des milliers de cellules filles appelées mérozoïtes dans le sang (contrairement au P. vivax apparenté , P. knowlesi ne produit pas d' hypnozoïtes latents dans le sang. le foie). Les mérozoïtes dans le sang se fixent et envahissent les globules rouges du primate . À l'intérieur du globule rouge, le parasite progresse à travers plusieurs stades morphologiquement distincts, appelés stade en anneau, trophozoïte et schizonte. Les globules rouges infectés par le schizonte finissent par éclater, libérant jusqu'à 16 nouveaux mérozoïtes dans la circulation sanguine qui infectent de nouveaux globules rouges et poursuivent le cycle. P. knowlesi complète ce cycle de globules rouges toutes les 24 heures, ce qui le rend particulièrement rapide parmi les espèces de Plasmodium infectant les primates (ce qui prend généralement 48 ou 72 heures). Parfois, les parasites qui envahissent les globules rouges entrent plutôt dans un cycle sexuel, se développant sur environ 48 heures en des formes sexuées distinctes appelées microgamétocytes ou macrogamétocytes. Ces gamétocytes restent dans le sang pour être ingérés par les moustiques.
Un moustique ingère des gamétocytes lorsqu'il prend un repas de sang d'un hôte primate infecté. Une fois à l'intérieur de l'intestin du moustique, les gamétocytes se transforment en gamètes puis fusionnent pour former un zygote diploïde . Le zygote mûrit en un ookinète , qui migre à travers la paroi de l'intestin du moustique et se développe en un oocyste . L'oocyste libère alors des milliers de sporozoïtes, qui migrent à travers le moustique vers les glandes salivaires. L'ensemble de ce processus chez le moustique prend de 12 à 15 jours.
Biologie cellulaire
P. knowlesi ressemble largement aux autres espèces de Plasmodium dans sa biologie cellulaire. Son génome est constitué de 23,5 mégabases d'ADN séparées en 14 chromosomes . Il contient environ 5 200 gènes codant pour des protéines, dont 80 % ont des orthologues présents chez P. falciparum et P. vivax . Le génome contient deux grandes familles de gènes propres à P. knowlesi : la famille SICAvar (variant d'agglutination cellulaire infecté par le schizonte), qui est impliquée dans l'affichage de différents antigènes à la surface du parasite pour échapper au système immunitaire, et le Kir (knowlesi intercalé répéter), impliqué dans l'adhérence des globules rouges parasités aux parois des vaisseaux sanguins.
En tant qu'apicomplexe , P. knowlesi a plusieurs structures distinctives à son extrémité apicale qui sont spécialisées pour envahir les cellules hôtes. Ceux-ci incluent les gros rhoptries bulbeux , les micronèmes plus petits et les granules denses dispersés , dont chacun sécrète des effecteurs pour entrer et modifier la cellule hôte. Comme les autres apicomplexes, P. knowlesi possède également deux organites d' origine endosymbiotique : une seule grande mitochondrie et l' apicoplaste , tous deux impliqués dans le métabolisme du parasite .
Évolution et taxonomie
Malgré sa similitude morphologique avec P. malariae , P. knowlesi est le plus étroitement apparenté à P. vivax ainsi qu'à d'autres espèces de Plasmodium qui infectent les primates non humains. Le dernier ancêtre commun de toutes les souches modernes de P. knowlesi a vécu il y a environ 98 000 à 478 000 ans. Parmi les parasites humains, P. knowlesi est le plus étroitement apparenté à P. vivax , dont il a divergé il y a entre 18 millions et 34 millions d'années. Un arbre phylogénétique comparant les espèces de Plasmodium qui infectent les humains est présenté ci-dessous :
| Sous-genre Plasmodium |
|
||||||||||||||||||
La population de parasites P. knowlesi est génétiquement plus diversifiée que celle de P. falciparum ou P. vivax . Au sein de P. knowlesi, il existe trois sous-populations génétiquement distinctes. Deux sont présents dans les mêmes régions de Bornéo malaisien et peuvent infecter des moustiques différents. Le troisième n'a été trouvé que dans des isolats de laboratoire provenant d'autres régions d'Asie du Sud-Est. Les populations de P. knowlesi isolées de macaques sont génétiquement impossibles à distinguer de celles isolées d'infections humaines, ce qui suggère que les mêmes populations de parasites peuvent infecter les humains et les macaques de manière interchangeable.
Trois sous-espèces de P. knowlesi ont été décrites sur la base de différences d'apparence dans les frottis sanguins colorés : P. knowlesi edesoni , P. knowlesi sintoni et P. knowlesi arimai , qui ont été isolées respectivement de Malaisie, de Java et de Taïwan. La relation entre ces sous-espèces décrites et les populations décrites dans la littérature moderne n'est pas claire.
Distribution
Plasmodium knowlesi se trouve dans toute l' Asie du Sud - Est , où il contamine principalement le macaque à longue queue , macaque à queue de cochon , et Semnopithèque de Sumatra ainsi que les moustiques vecteurs Anopheles hackeri en Malaisie péninsulaire et Anopheles latens au Sarawak . Les macaques à longue queue dans la nature peuvent être infectés par P. knowlesi sans aucune maladie apparente, même lorsqu'ils sont simultanément infectés par diverses autres espèces de Plasmodium . P. knowlesi est rarement trouvé en dehors de l'Asie du Sud-Est, probablement parce que les moustiques qu'il infecte sont limités à cette région.
Rôle dans la maladie humaine
P. knowlesi peut provoquer un paludisme simple et grave chez l'homme. Les personnes infectées ont presque toujours de la fièvre et des frissons . Les personnes atteintes de paludisme à P. knowlesi non compliqué présentent souvent également des maux de tête, des douleurs articulaires, des malaises et une perte d'appétit. Moins fréquemment, les gens rapportent de la toux, des douleurs abdominales, de la diarrhée, des nausées et des vomissements. Les tests de laboratoire des personnes infectées montrent presque toujours une faible numération plaquettaire , bien que cela entraîne rarement des problèmes de saignement. Contrairement à d'autres paludismes humains, le paludisme à P. knowlesi a tendance à avoir des pics de fièvre toutes les 24 heures, et est donc souvent appelé paludisme quotidien ou « quotidien ». Le paludisme à P. knowlesi non compliqué peut être traité avec des médicaments antipaludiques .
Au moins 10 % des personnes infectées par P. knowlesi développent un paludisme grave. Le paludisme grave à P. knowlesi ressemble au paludisme grave causé par P. falciparum . Les personnes atteintes d'une maladie grave peuvent ressentir un essoufflement, des douleurs abdominales et des vomissements. Au fur et à mesure que la maladie progresse, les parasites se répliquent à des niveaux très élevés dans le sang, provoquant probablement des lésions rénales aiguës, une jaunisse , un choc et une détresse respiratoire. L'acidose métabolique est rare, mais peut survenir dans des cas particulièrement graves. Contrairement au paludisme à P. falciparum, le paludisme grave à P. knowlesi provoque rarement un coma ou une anémie grave . Environ 1 à 2 % des cas sont mortels.
Diagnostic
Le paludisme est traditionnellement diagnostiqué en examinant des frottis sanguins colorés au Giemsa au microscope ; cependant, différencier P. knowlesi des autres espèces de Plasmodium de cette manière est difficile en raison de leur apparence similaire. Les parasites au stade annulaire de P. knowlesi colorés au Giemsa ressemblent aux stades annulaires de P. falciparum , apparaissant sous la forme d'un cercle avec un ou deux points sombres de chromatine . Les trophozoïtes plus âgés semblent plus dispersés, formant une forme rectangulaire répartie à travers la cellule hôte appelée « forme de bande » qui ressemble au stade similaire de P. malariae . Au cours de cette étape, des points apparaissent parfois à travers le globule rouge de l'hôte, appelé « pointillé de Sinton et Mulligans ». Les schizontes apparaissent, comme d'autres espèces de Plasmodium , sous forme d'amas de mérozoïtes violets entourant un pigment central de couleur foncée.
En raison de la similitude morphologique entre les espèces de Plasmodium , un diagnostic erroné d' infection à P. knowlesi comme P. falciparum , P. malariae ou P. vivax est courant. Alors que certains tests de diagnostic rapide peuvent détecter P. knowlesi , ils ont tendance à avoir une sensibilité et une spécificité médiocres et ne sont donc pas toujours fiables. La détection de l'acide nucléique par PCR ou PCR en temps réel est la méthode la plus fiable pour détecter P. knowlesi et la différencier des infections d'autres espèces de Plasmodium . Cependant, en raison de la nature relativement lente et coûteuse de la PCR, celle-ci n'est pas disponible dans de nombreuses zones d'endémie. Des méthodes d' amplification isotherme à médiation par boucle de détection de P. knowlesi ont également été développées, mais ne sont pas encore largement utilisées.
Traitement
Parce que P. knowlesi ne met que 24 heures pour terminer son cycle érythrocytaire, il peut rapidement entraîner des niveaux très élevés de parasitémie avec des conséquences fatales. Pour les personnes atteintes de paludisme non compliqué , l' Organisation mondiale de la santé recommande un traitement par thérapie combinée à base d' artémisinine (ACT) ou de chloroquine . Pour les personnes atteintes de paludisme grave , l'Organisation mondiale de la santé recommande l'administration d' artésunate par voie intraveineuse pendant au moins 24 heures, suivie d'un traitement par ACT. De plus, les premiers essais de médicaments ont suggéré que des combinaisons de chloroquine et de primaquine , d'artésunate et de méfloquine , d' artéméther et de luméfantrine et de chloroquine seule pourraient être des traitements efficaces pour le paludisme à P. knowlesi non compliqué . Il n'y a aucune preuve que P. knowlesi développe une résistance aux antipaludiques actuels.
Épidémiologie
P. knowlesi est la cause la plus fréquente de paludisme en Malaisie , et des cas de paludisme à P. knowlesi ont été signalés dans la plupart des pays d'Asie du Sud-Est ainsi que chez des voyageurs de la région.
L'infection par P. knowlesi est associée à des facteurs socio-économiques et de mode de vie qui amènent les gens dans les forêts denses où se trouvent couramment les moustiques hôtes. En particulier, ceux qui travaillent dans la forêt ou à sa lisière, tels que les agriculteurs, les chasseurs et les bûcherons, courent un risque accru d'infection. Probablement pour cette raison, les hommes sont infectés plus fréquemment que les femmes, et les adultes sont infectés plus fréquemment que les enfants.
Recherche
P. knowlesi a longtemps été utilisé comme modèle de recherche pour étudier l'interaction entre le parasite et l'hôte et développer des vaccins et des médicaments antipaludiques. Son utilité en tant que modèle de recherche est en partie due à sa capacité à infecter les macaques rhésus, un primate modèle de laboratoire commun. Les macaques rhésus sont très sensibles à P. knowlesi et peuvent être infectés par une piqûre de moustique, une injection de sporozoïtes ou une injection de parasites au stade sanguin. Les singes infectés développent certaines caractéristiques du paludisme humain, notamment l'anémie et l'hypertrophie de la rate et du foie. L'infection est généralement mortelle si elle n'est pas traitée, la cause de la mort étant apparemment une défaillance circulatoire caractérisée par l'adhésion des globules rouges infectés aux parois des vaisseaux sanguins . Les singes peuvent être guéris de l'infection par un traitement avec des antipaludiques ; une infection répétée suivie d'une guérison a pour résultat que les singes développent une certaine immunité contre l'infection, un sujet qui a également fait l'objet de recherches approfondies.
P. knowlesi est également utilisé pour la recherche in vitro sur la biologie cellulaire de Plasmodium . Des sporozoïtes isolés peuvent infecter les hépatocytes rhésus primaires , permettant l' étude in vitro du stade hépatique du parasite. De plus, P. knowlesi et P. falciparum sont les seules espèces de Plasmodium qui peuvent être maintenues en continu dans des globules rouges en culture , à la fois rhésus et humains. Facilitant la recherche en biologie moléculaire, le génome de P. knowlesi a été séquencé et est disponible sur PlasmoDB et d'autres référentiels en ligne. P. knowlesi peut être génétiquement modifié en laboratoire par transfection soit dans le système modèle du macaque rhésus, soit en culture de cellules sanguines. Les stades infectant le sang et les sporozoïtes peuvent être conservés à long terme par congélation avec du glycérolyte , permettant la préservation des souches d'intérêt.
Histoire
Le médecin italien Giuseppe Franchini a décrit pour la première fois ce qui aurait pu être P. knowlesi en 1927 lorsqu'il a noté un parasite distinct de P. cynomolgi et P. inui dans le sang d'un macaque à longue queue. En 1931, le parasite est à nouveau observé chez un macaque à longue queue par HGM Campbell lors de ses travaux sur le kala-azar ( leishmaniose viscérale ) à Calcutta ; Le collègue de Campbell, Lionel Everard Napier, a prélevé du sang sur le singe affecté et a inoculé trois singes de laboratoire, dont un macaque rhésus qui a développé une infection grave. Campbell et Napier ont donné le singe infecté à Biraj Mohan Das Gupta qui a pu maintenir le parasite par passage en série à travers des singes. En 1932, Das Gupta et son superviseur Robert Knowles ont décrit la morphologie du parasite dans le sang de macaque et ont démontré qu'il pouvait infecter trois patients humains (dans chaque cas, il était utilisé pour induire de la fièvre dans l'espoir de traiter une autre infection). Toujours en 1932, John Sinton et HW Mulligan ont décrit plus en détail la morphologie du parasite dans les cellules sanguines, l'ont déterminé comme une espèce distincte des autres décrites et l'ont nommé Plasmodium knowlesi en l'honneur de Robert Knowles.
Peu de temps après, en 1935 CE Van Rooyen et George R. Pile ont rapporté avoir utilisé une infection à P. knowlesi pour traiter la paralysie générale chez les patients psychiatriques. P. knowlesi allait être utilisé comme agent pyrétique général pour diverses maladies, en particulier la neurosyphilis pour laquelle il était utilisé jusqu'en 1955 au moins. Alors que Cyril Garnham avait suggéré en 1957 que P. knowlesi pourrait infecter naturellement les humains, le premier cas documenté d'un humain naturellement infecté par P. knowlesi était en 1965 chez un arpenteur de l'armée américaine qui a développé des frissons et de la fièvre après un déploiement de cinq jours en Malaisie. Sur la base de cette découverte, une équipe de l'Institut de recherche médicale de la Malaisie péninsulaire a mené une enquête auprès des personnes vivant à proximité des macaques, mais n'a pas réussi à trouver de preuves que le paludisme simien était transmis à l'homme.
Au cours des années 1960 et 1970, des groupes de recherche scientifique ont utilisé P. knowlesi comme modèle de recherche pour faire des découvertes fondamentales sur le paludisme. En 1965 et 1972, plusieurs groupes ont caractérisé comment la variation antigénique de P. knowlesi contribuait à l'évasion immunitaire et à l'infection chronique. En 1975, Louis H. Miller et d'autres ont montré que P. knowlesi avait besoin du facteur Duffy à la surface des globules rouges pour les envahir (ils allaient montrer la même exigence pour P. vivax un an plus tard).
Les travaux sur P. knowlesi en tant que parasite du paludisme humain ont été revitalisés en 2004, lorsque Balbir Singh et d'autres ont utilisé la PCR pour montrer que plus de la moitié d'un groupe d'humains diagnostiqués avec le paludisme à P. malariae à Bornéo en Malaisie étaient en fait infectés par P. knowlesi . Au cours de la décennie suivante, plusieurs chercheurs ont utilisé des méthodes de détection moléculaire capables de distinguer P. knowlesi de parasites morphologiquement similaires pour attribuer une proportion croissante de cas de paludisme à P. knowlesi dans toute l'Asie du Sud-Est. Des travaux avec des échantillons d'archives ont montré que l'infection par ce parasite s'est produite en Malaisie au moins depuis les années 1990.
Les références
Liens externes
- Page du CDC sur le paludisme
- Page de l'OMS sur le paludisme
- Données sur le génome de P. knowlesi
- Court métrage sur la découverte du rôle de P. knowlesi dans le paludisme humain
| Scholia a un profil thématique pour Plasmodium knowlesi . |