Diacétate de sodium - Sodium diacetate
 Diacétate de sodium
|
|
| Des noms | |
|---|---|
|
Nom IUPAC
Diacétate de sodium
|
|
| Autres noms
Diacétate de sodium (anhydre); Acétate d'hydrogène de sodium; Acétate d'acide de sodium
|
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChemSpider | |
| Carte Info ECHA |
100,004,378 |
| Engrener | diacétate de sodium diacétate |
|
PubChem CID
|
|
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 4 H 7 Na O 4 | |
| Masse molaire | 142,086 g · mol −1 |
| Apparence | poudre blanche |
| Odeur | Odeur d'acide acétique (vinaigre) |
| 1 g / mL | |
| Solubilité dans l'alcool | Légèrement |
| Solubilité dans l' éther | Insoluble |
| Dangers | |
| Fiche de données de sécurité | Diacétate de sodium PubChem LCSS |
| Pictogrammes SGH |
 
|
| Mot de signalisation SGH | Danger |
| H318 , H319 | |
| P264 , P280 , P305 + 351 + 338 , P310 , P337 + 313 | |
| Risque d' inhalation | Irritant |
| Risque oculaire | Irritant |
| point de rupture | > 150 ° C (302 ° F) |
| Dose ou concentration létale (DL, LC): | |
|
DL 50 ( dose médiane )
|
> 2000 mg / kg (rat, cutané), 5600 mg / kg (rat, oral) |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 ° C [77 ° F], 100 kPa). |
|
| Références Infobox | |
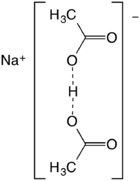
Le diacétate de sodium est un composé de formule NaH ( C
2H
3O
2)
2. C'est un sel d' acide acétique . C'est un solide incolore qui est utilisé dans les assaisonnements et comme agent antimicrobien .
Préparation et structure
Le sel se forme lors de la demi- neutralisation de l'acide acétique suivie de l'évaporation de la solution. Il peut être considéré comme le résultat d'une homoassociation , un effet qui améliore l'acidité de l'acide acétique en solution concentrée:
- 2 CH 3 CO 2 H + NaOH → Na + [(CH 3 CO 2 ) 2 H] - + H 2 O
Également décrit comme le sel d' acide sodique de l'acide acétique, il est mieux décrit comme le sel de sodium de l' anion à liaison hydrogène (CH 3 CO 2 ) 2 H - . La distance O ··· O est d'environ 2,47 angströms . L'espèce n'a pas d'existence significative en solution mais forme des cristaux stables .
Applications
En tant qu'additif alimentaire, il porte le numéro E E262 et est utilisé pour donner une saveur de sel et de vinaigre.
Voir également
Les références
- ^ PubChem. "Diacétate de sodium" . PubChem . Récupéré 24/10/2019 .
- ^ A b c d e PubChem. "Diacétate de sodium" . PubChem . Récupéré 24/10/2019 .
- ^ Barrow, Michael J .; Currie, Murdoch; Muir, Kenneth W .; Speakman, J. Clare; White, David N, J. "Structures cristallines de certains sels acides d'acides monobasiques. XVII. Structure du diacétate d'hydrogène de sodium, redéterminée par diffraction neutronique" Journal of the Chemical Society, Perkin Transactions 2: Physical Organic Chemistry 1975, pp. 15- 18. doi : 10.1039 / P29750000015
- ^ Peter J. Taormina "Implications de la réduction de sel et de sodium sur la sécurité alimentaire microbienne" dans des revues critiques dans la science alimentaire et la nutrition, 2010, vol. 50, 209-227. doi : 10.1080 / 10408391003626207
|
Halogénures d'acétyle et sels de l' ion acétate
|
|||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AcOH | Il | ||||||||||||||||||
| LiOAc |
Be (OAc) 2 BeAcOH |
B (OAc) 3 |
ROAc AcOAc |
NH 4 OAc | AcOOH | FAc | Ne | ||||||||||||
| NaOAc | Mg (OAc) 2 |
Al (OAc) 3 ALSOL Al (OAc) 2 OH Al 2 SO 4 (OAc) 4 |
Si | P | S | ClAc | Ar | ||||||||||||
| KOAc | Ca (OAc) 2 | Sc (OAc) 3 | Ti (OAc) 4 | VO (OAc) 3 |
Cr (OAc) 2 Cr (OAc) 3 |
Mn (OAc) 2 Mn (OAc) 3 |
Fe (OAc) 2 Fe (OAc) 3 |
Co (OAc) 2 , Co (OAc) 3 |
Ni (OAc) 2 | Cu (OAc) 2 | Zn (OAc) 2 | Ga (OAc) 3 | Ge | Comme (OAc) 3 | Se | BrAc | Kr | ||
| RbOAc | Sr (OAc) 2 | Y (OAc) 3 | Zr (OAc) 4 | Nb | Mo (OAc) 2 | Tc |
Ru (OAc) 2 Ru (OAc) 3 Ru (OAc) 4 |
Rh 2 (OAc) 4 | Pd (OAc) 2 | AgOAc | Cd (OAc) 2 | Dans |
Sn (OAc) 2 Sn (OAc) 4 |
Sb (OAc) 3 | Te | IAc | Xe | ||
| CsOAc | Ba (OAc) 2 | Hf | Ta | W | Ré | Os | Ir | Pt (OAc) 2 | Au |
Hg 2 (OAc) 2 , Hg (OAc) 2 |
TlOAc Tl (OAc) 3 |
Pb (OAc) 2 Pb (OAc) 4 |
Bi (OAc) 3 | Po | À | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| La (OAc) 3 | Ce (OAc) x | Pr | Nd | PM | Sm (OAc) 3 | Eu (OAc) 3 | Gd (OAc) 3 | Tb | Dy (OAc) 3 | Ho (OAc) 3 | Euh | Tm | Yb (OAc) 3 | Lu (OAc) 3 | |||||
| Ac | Th | Pennsylvanie | UO 2 (OAc) 2 | Np | Pu | Un m | Cm | Bk | Cf | Es | Fm | Maryland | Non | G / D | |||||
