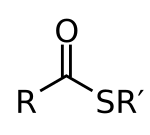
Thioester - Thioester
En chimie, les thioesters sont des composés avec le groupe fonctionnel R–S–CO–R'. Ils sont analogues aux esters carboxylates, le soufre dans le thioester jouant le rôle d'oxygène de liaison dans l'ester carboxylate. Ils sont le produit d'une estérification entre un acide carboxylique et un thiol . En biochimie , les thioesters les plus connus sont des dérivés de la coenzyme A , par exemple l' acétyl-CoA .
Synthèse
La voie la plus typique vers le thioester implique la réaction d'un chlorure d'acide avec un sel de métal alcalin d'un thiol :
- RSNa + R′COCl → R′COSR + NaCl
Une autre voie courante implique le déplacement des halogénures par le sel de métal alcalin d'un acide thiocarboxylique . Par exemple, les esters de thioacétate sont couramment préparés par alkylation de thioacétate de potassium :
- CH 3 COSK + RX → CH 3 COSR + KX
L'alkylation analogue d'un sel d'acétate est rarement pratiquée. L'alkylation peut être réalisée en utilisant des bases de Mannich et l'acide thiocarboxylique :
- CH 3 COSH + R′ 2 NCH 2 OH → CH 3 COSCH 2 NR′ 2 + H 2 O
Les thioesters peuvent être préparés par condensation de thiols et d'acides carboxyliques en présence d'agents déshydratants :
- RSH + R′CO 2 H → RSC(O)R′ + H 2 O
Un agent de déshydratation typique est le DCC . Des efforts pour améliorer la durabilité de la synthèse de thioesters ont également été signalés en utilisant un réactif de couplage plus sûr T3P et un solvant plus vert, la cyclopentanone . Les anhydrides d'acide et certaines lactones donnent également des thioesters par traitement avec des thiols en présence d'une base.
Les thioesters peuvent être commodément préparés à partir d'alcools par la réaction de Mitsunobu , en utilisant de l' acide thioacétique .
Ils surviennent également par carbonylation d' alcynes et d' alcènes en présence de thiols.
Réactions
Les thioesters s'hydrolysent en thiols et en acide carboxylique :
- RC(O)SR' + H 2 O → RCO 2 H + RSH
Le centre carbonyle dans les thioesters est plus réactif envers les nucléophiles aminés pour donner des amides :
Dans une réaction apparentée, mais en utilisant un métal mou pour capturer le thiolate, les thioesters sont convertis en esters. Les thioesters fournissent une chimiosélectivité utile dans la synthèse de biomolécules.
Une réaction unique aux thioesters est le couplage de Fukuyama , dans lequel le thioester est couplé à un halogénure d'organozinc par un catalyseur au palladium pour donner une cétone.

Biochimie

Les thioesters sont des intermédiaires courants dans de nombreuses réactions de biosynthèse, notamment la formation et la dégradation des acides gras et du mévalonate , précurseur des stéroïdes. Les exemples incluent le malonyl-CoA , l' acétoacétyl-CoA , le propionyl-CoA , le cinnamoyl-CoA et les thioesters de protéine porteuse d'acyle (ACP). L'acétogenèse se déroule via la formation d' acétyl-CoA . La biosynthèse de la lignine , qui constitue une grande partie de la biomasse terrestre de la Terre, se fait via un dérivé thioester de l'acide caféique . Ces thioesters se présentent de manière analogue à ceux préparés par synthèse, la différence étant que l'agent de déshydratation est l'ATP. De plus, les thioesters jouent un rôle important dans le marquage des protéines avec l' ubiquitine , qui marque la protéine pour la dégradation.
L'oxydation de l'atome de soufre dans les thioesters (thiolactones) est postulée dans la bioactivation des promédicaments antithrombotiques ticlopidine, clopidogrel et prasugrel.
Thioesters et l'origine de la vie
Comme posé dans un "Monde Thioester", les thioesters sont des précurseurs possibles de la vie. Comme l' explique Christian de Duve :
Il est révélateur que les thioesters soient des intermédiaires obligatoires dans plusieurs processus clés dans lesquels l' ATP est soit utilisé soit régénéré. Les thioesters sont impliqués dans la synthèse de tous les esters , y compris ceux trouvés dans les lipides complexes . Ils participent également à la synthèse d'un certain nombre d'autres composants cellulaires, notamment des peptides , des acides gras , des stérols , des terpènes , des porphyrines et autres. De plus, les thioesters sont formés en tant qu'intermédiaires clés dans plusieurs processus particulièrement anciens qui aboutissent à l'assemblage d'ATP. Dans ces deux cas, le thioester est plus proche que l'ATP du processus qui utilise ou produit de l'énergie. En d'autres termes, les thioesters auraient pu jouer le rôle d'ATP dans un "monde thioester" initialement dépourvu d'ATP. Finalement, [ces] thioesters auraient pu servir à inaugurer l'ATP grâce à sa capacité à soutenir la formation de liaisons entre les groupes phosphate .
Cependant, en raison du changement d'énergie libre élevé de l'hydrolyse du thioester et, par conséquent, de leurs faibles constantes d'équilibre, il est peu probable que ces composés se soient accumulés de manière abiotique dans une mesure significative, en particulier dans des conditions de ventilation hydrothermale.
thionoesters

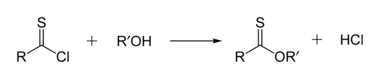
Les thioesters sont isomères avec les thioesters. Dans un thionoester, le soufre remplace l'oxygène du carbonyle dans un ester. Le thionobenzoate de méthyle est C 6 H 5 C(S)OCH 3 . De tels composés sont typiquement préparés par la réaction du chlorure de thioacyle avec un alcool.
Ils peuvent également être préparés par réaction du réactif de Lawesson avec des esters ou par traitement de sels pinner avec du sulfure d'hydrogène. En variante, divers thionoesters peuvent être préparés par transestérification d'un méthylthionoester existant avec un alcool dans des conditions catalysées par une base.