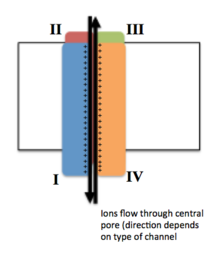
Canal ionique voltage-dépendant - Voltage-gated ion channel
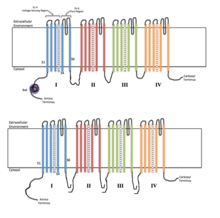 Chacun des quatre domaines homologues constitue une sous-unité du canal ionique. Les segments de détection de tension S4 (marqués de symboles +) sont affichés comme chargés.
| |
| Identifiants | |
|---|---|
| symbole | CIV |
| Clan Pfam | CL0030 |
| TCDB | 1.A.1 |
| superfamille OPM | 8 |
| protéine OPM | 2a79 |
Les canaux ioniques voltage-dépendants sont une classe de protéines transmembranaires qui forment des canaux ioniques qui sont activés par des changements dans le potentiel membranaire électrique à proximité du canal. Le potentiel membranaire modifie la conformation des protéines du canal, régulant leur ouverture et leur fermeture. Les membranes cellulaires sont généralement imperméables aux ions , elles doivent donc diffuser à travers la membrane à travers des canaux protéiques transmembranaires. Ils ont un rôle crucial dans les cellules excitables telles que les tissus neuronaux et musculaires, permettant une dépolarisation rapide et coordonnée en réponse au changement de tension de déclenchement . Trouvés le long de l' axone et au niveau de la synapse , les canaux ioniques voltage-dépendants propagent les signaux électriques de manière directionnelle. Les canaux ioniques voltage-dépendants sont généralement spécifiques aux ions, et des canaux spécifiques aux ions sodium (Na + ), potassium (K + ), calcium (Ca 2+ ) et chlorure (Cl − ) ont été identifiés. L'ouverture et la fermeture des canaux sont déclenchées par la modification de la concentration ionique, et donc du gradient de charge, entre les côtés de la membrane cellulaire.
Structure
Les canaux ioniques voltage-dépendants sont généralement composés de plusieurs sous-unités disposées de telle manière qu'il y a un pore central à travers lequel les ions peuvent voyager le long de leurs gradients électrochimiques . Les canaux ont tendance à être spécifiques aux ions, bien que des ions de taille et de charge similaires puissent parfois les traverser. La fonctionnalité des canaux ioniques voltage-dépendants est attribuée à ses trois principales unités discrètes : le capteur de tension, le pore ou la voie conductrice et la grille. Les canaux Na + , K + et Ca 2+ sont composés de quatre domaines transmembranaires disposés autour d'un pore central ; ces quatre domaines font partie d'une seule sous-unité dans le cas de la plupart des canaux Na + et Ca 2+ , alors qu'il existe quatre sous-unités , chacune contribuant à un domaine transmembranaire, dans la plupart des canaux K + . Les segments transmembranaires , désignés S1-S6, prennent tous la forme d' hélices alpha avec des fonctions spécialisées. Les cinquième et sixième segments transmembranaires (S5 et S6) et la boucle de pores jouent le rôle principal de conduction ionique, comprenant la grille et les pores du canal, tandis que S1-S4 servent de région de détection de tension. Les quatre sous-unités peuvent être identiques ou différentes les unes des autres. En plus des quatre sous-unités α centrales, il existe également des sous-unités régulatrices, à activité oxydoréductase , qui sont situées sur la surface interne de la membrane cellulaire et ne traversent pas la membrane, et qui sont co-assemblées avec les sous-unités dans le réticulum endoplasmique .
Mécanisme
Des études structurales cristallographiques d'un canal potassique ont montré que, lorsqu'une différence de potentiel est introduite sur la membrane, le champ électrique associé induit un changement de conformation du canal potassique. Le changement de conformation déforme suffisamment la forme des protéines du canal de telle sorte que la cavité, ou le canal, s'ouvre pour permettre à l'influx ou à l'efflux de se produire à travers la membrane. Ce mouvement des ions vers le bas de leurs gradients de concentration génère par la suite un courant électrique suffisant pour dépolariser la membrane cellulaire.
Les canaux sodiques voltage-dépendants et les canaux calciques sont constitués d'un seul polypeptide avec quatre domaines homologues. Chaque domaine contient 6 hélices alpha couvrant la membrane . L'une de ces hélices, S4, est l'hélice de détection de tension. Le segment S4 contient de nombreuses charges positives telles qu'une charge positive élevée à l'extérieur de la cellule repousse l'hélice, maintenant le canal dans son état fermé.
En général, la partie de détection de tension du canal ionique est responsable de la détection des changements de potentiel transmembranaire qui déclenchent l'ouverture ou la fermeture du canal. On pense généralement que les hélices alpha S1-4 remplissent ce rôle. Dans les canaux potassium et sodium, les hélices S4 à détection de tension contiennent des résidus de lysine ou d'arginine chargés positivement dans des motifs répétés. Au repos, la moitié de chaque hélice S4 est en contact avec le cytosol cellulaire. Lors de la dépolarisation, les résidus chargés positivement sur les domaines S4 se déplacent vers la surface exoplasmique de la membrane. On pense que les 4 premières arginines représentent le courant de déclenchement, se déplaçant vers le solvant extracellulaire lors de l'activation du canal en réponse à la dépolarisation de la membrane. Le mouvement de 10 à 12 de ces charges positives liées aux protéines déclenche un changement de conformation qui ouvre le canal. Le mécanisme exact par lequel ce mouvement se produit n'est pas actuellement convenu, mais les modèles canonique, transporteur, pagaie et tordu sont des exemples de théories actuelles.
Le mouvement du capteur de tension déclenche un changement de conformation de la grille de la voie conductrice, contrôlant le flux d'ions à travers le canal.
La partie fonctionnelle principale du domaine protéique sensible au voltage de ces canaux contient généralement une région composée d'hélices S3b et S4, connue sous le nom de « pagaie » en raison de sa forme, qui semble être une séquence conservée , interchangeable à travers une grande variété de cellules et espèces. Une palette de capteur de tension similaire a également été trouvée dans une famille de phosphatases sensibles à la tension chez diverses espèces. Le génie génétique de la région de la pagaie à partir d'une espèce d' archébactérie des volcans dans les canaux potassiques du cerveau de rat aboutit à un canal ionique entièrement fonctionnel, tant que toute la pagaie intacte est remplacée. Cette « modularité » permet d'utiliser des systèmes modèles simples et peu coûteux pour étudier la fonction de cette région, son rôle dans la maladie et le contrôle pharmaceutique de son comportement plutôt que de se limiter à des préparations mal caractérisées, coûteuses et/ou difficiles à étudier.
Bien que les canaux ioniques voltage-dépendants soient généralement activés par dépolarisation membranaire , certains canaux , tels que les canaux ioniques potassiques redresseurs vers l' intérieur , sont activés à la place par hyperpolarisation .
On pense que la grille est couplée aux régions de détection de tension des canaux et semble contenir une obstruction mécanique au flux d'ions. Alors que le domaine S6 a été reconnu comme le segment agissant comme cette obstruction, son mécanisme exact est inconnu. Les explications possibles incluent : le segment S6 effectue un mouvement de type ciseaux permettant aux ions de passer à travers, le segment S6 se brise en deux segments permettant le passage des ions à travers le canal, ou le canal S6 sert de porte lui-même. Le mécanisme par lequel le mouvement du segment S4 affecte celui de S6 est encore inconnu, cependant il est théorisé qu'il existe un linker S4-S5 dont le mouvement permet l'ouverture de S6.
L'inactivation des canaux ioniques se produit dans les millisecondes suivant l'ouverture. On pense que l'inactivation est médiée par une porte intracellulaire qui contrôle l'ouverture du pore à l'intérieur de la cellule. Cette porte est modélisée comme une boule attachée à une chaîne flexible . Lors de l'inactivation, la chaîne se replie sur elle-même et la bille bloque le flux d'ions à travers le canal. L'inactivation rapide est directement liée à l'activation provoquée par les mouvements intramembranaires des segments S4, bien que le mécanisme reliant le mouvement de S4 et l'engagement de la porte d'inactivation soit inconnu.
Différents types
Canaux de sodium (Na + )
Les canaux sodiques ont des propriétés fonctionnelles similaires dans de nombreux types cellulaires différents. Alors que dix gènes humains codant pour les canaux sodiques ont été identifiés, leur fonction est généralement conservée entre les espèces et les différents types de cellules.
Canaux calciques (Ca 2+ )
Avec seize gènes identifiés différents pour les canaux calciques humains, ce type de canal diffère en fonction d'un type cellulaire à l'autre. Les canaux Ca 2+ produisent des potentiels d'action similaires aux canaux Na + dans certains neurones. Ils jouent également un rôle dans la libération de neurotransmetteurs dans les terminaisons nerveuses pré-synaptiques . Dans la plupart des cellules, les canaux Ca 2+ régulent une grande variété de processus biochimiques en raison de leur rôle dans le contrôle des concentrations intracellulaires de Ca 2+ .
Canaux de potassium (K + )
Les canaux potassiques sont la classe la plus vaste et la plus diversifiée de canaux voltage-dépendants, avec plus de 100 gènes humains codant. Ces types de canaux diffèrent considérablement par leurs propriétés de déclenchement ; certains s'inactivant extrêmement lentement et d'autres s'inactivant extrêmement rapidement. Cette différence de temps d'activation influence la durée et la vitesse de déclenchement du potentiel d'action, ce qui a un effet significatif sur la conduction électrique le long d'un axone ainsi que sur la transmission synaptique. Les canaux potassiques diffèrent par leur structure des autres canaux en ce qu'ils contiennent quatre sous-unités polypeptidiques séparées, tandis que les autres canaux contiennent quatre domaines homologues mais sur une seule unité polypeptidique.
Canaux chlorure (Cl − )
Les canaux chlorure sont présents dans tous les types de neurones. Avec la responsabilité principale de contrôler l'excitabilité, les canaux chlorure contribuent au maintien du potentiel de repos cellulaire et aident à réguler le volume cellulaire.
Canaux de protons (H + )
Les canaux de protons voltage-dépendants transportent des courants médiés par des ions hydrogène sous forme d' hydronium et sont activés par dépolarisation d'une manière dépendante du pH . Ils fonctionnent pour éliminer l'acide des cellules.
Phylogénétique
Des études phylogénétiques de protéines exprimées dans des bactéries ont révélé l'existence d'une superfamille de canaux sodiques voltage-dépendants. Des études ultérieures ont montré qu'une variété d'autres canaux ioniques et transporteurs sont phylogénétiquement lié aux canaux ioniques voltage-dépendants, y compris rectification entrante K + canaux , récepteurs ryanodine-inositol 1,4,5-triphosphate Ca 2+ canaux , le potentiel de récepteur transitoire Ca 2+ canaux , les canaux cationiques de la polycystine , les canaux ioniques glutamate-dépendants , les canaux de chlorure dépendant du calcium , cation monovalent: antiporteurs de protons, type 1 , et les transporteurs de potassium .
Voir également
Les références
Liens externes
- IUPHAR-DB Sous-unités de canaux ioniques voltage-dépendants
- Le compendium de l'IUPHAR sur les canaux ioniques voltage-dépendants 2005
- Voltage-Dependent+Anion+Channels à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis