Fasciolose - Fasciolosis
| Fasciolose | |
|---|---|
| Autres noms | Fascioliase, fasciolase, distomatose, pourriture du foie |
 | |
| Fasciola hépatique | |
| Spécialité | Maladie infectieuse , hépatologie |
| Symptômes | Douleurs abdominales, nausées, peau jaune |
| Complications | Pancréatite , anémie |
| Causes | Vers plats Fasciola |
| Facteurs de risque | Manger du cresson cru |
| Méthode de diagnostic | Échantillon de selles |
| La prévention | Une bonne préparation des aliments |
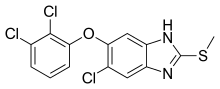
| Des médicaments | Triclabendazole |
| La fréquence | 2 millions |
La fasciolose est une infection parasitaire causée par la douve du foie Fasciola hepatica ainsi que par Fasciola gigantica . La maladie est une zoonose à trématodes transmise par les plantes et est classée comme une maladie tropicale négligée (MTN). Elle affecte les humains, mais son hôte principal est les ruminants tels que les bovins et les moutons . La maladie progresse à travers quatre phases distinctes; une phase d'incubation initiale de quelques jours à trois mois avec peu ou pas de symptômes ; une phase invasive ou aiguë qui peut se manifester par : fièvre, malaise, douleurs abdominales, symptômes gastro-intestinaux, urticaire, anémie , ictère et symptômes respiratoires . La maladie évolue ensuite vers une phase latente avec moins de symptômes et finalement vers une phase chronique ou obstructive des mois ou des années plus tard. A l'état chronique, la maladie provoque une inflammation des voies biliaires , de la vésicule biliaire et peut provoquer des calculs biliaires ainsi qu'une fibrose . Bien que l'inflammation chronique soit liée à une augmentation des taux de cancer, il n'est pas clair si la fasciolose est associée à un risque accru de cancer.
Jusqu'à la moitié des personnes infectées ne présentent aucun symptôme et le diagnostic est difficile car les œufs de vers sont souvent omis lors de l'examen des selles. Les méthodes de détection sont l'examen fécal, la détection d'anticorps spécifiques du parasite ou le diagnostic radiologique, ainsi que la laparotomie . En cas de suspicion d'épidémie, il peut être utile de garder une trace des antécédents alimentaires, ce qui est également utile pour exclure les diagnostics différentiels. L'examen fécal n'est généralement pas utile car les œufs de vers peuvent rarement être détectés dans la phase chronique de l'infection. Les œufs apparaissent d'abord dans les selles entre 9 et 11 semaines après l'infection. La cause de ceci est inconnue, et il est également difficile de faire la distinction entre les différentes espèces de fasciola ainsi que de les distinguer des échinostomes et des Fasciolopsis . La plupart des tests d'immunodiagnostic détectent l'infection avec une sensibilité très élevée, et comme la concentration chute après le traitement, c'est une très bonne méthode de diagnostic. Cliniquement, il n'est pas possible de les différencier des autres maladies du foie et de la bile . Les méthodes radiologiques peuvent détecter les lésions dans les infections aiguës et chroniques, tandis que la laparotomie détectera les lésions et aussi occasionnellement les œufs et les vers vivants.
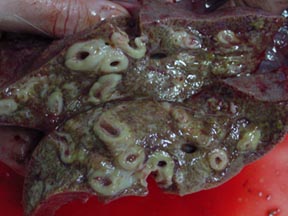
En raison de la taille du parasite, en tant qu'adulte F. hepatica : 20-30 × 13 mm (0,79-1,18 × 0,51 pouces) ou adulte F. gigantica : 25-75 × 12 mm (0,98-2,95 × 0,47 pouces), fasciolose est une grande préoccupation. La quantité de symptômes dépend du nombre de vers et du stade de l'infection. Le taux de mortalité est important chez les bovins (67,55 %) et les chèvres (24,61 %), mais généralement faible chez les humains. Le traitement au triclabendazole s'est avéré très efficace contre les vers adultes ainsi que contre divers stades de développement. Le praziquantel n'est pas efficace et les médicaments plus anciens tels que le bithionol sont modérément efficaces mais provoquent également plus d'effets secondaires. L'infection bactérienne secondaire causant une cholangite a également été une préoccupation et peut être traitée avec des antibiotiques, et la toxémie peut être traitée avec de la prednisolone .
Les humains sont infectés en mangeant des plantes aquatiques, principalement du cresson sauvage en Europe ou de la gloire du matin en Asie. L'infection peut également se produire en buvant de l'eau contaminée avec de jeunes fascioles flottantes ou en utilisant des ustensiles lavés avec de l'eau contaminée. Les plantes cultivées ne propagent pas la maladie avec la même capacité. L'infection humaine est rare, même si le taux d'infection est élevé chez les animaux. Des taux particulièrement élevés d'infection humaine ont été trouvés en Bolivie, au Pérou et en Égypte, et cela peut être dû à la consommation de certains aliments. Aucun vaccin n'est disponible pour protéger les personnes contre l' infection à Fasciola . Les mesures préventives sont principalement le traitement et l'immunisation du bétail, qui sont nécessaires pour accueillir le cycle vivant des vers. Des vaccins vétérinaires sont en cours de développement et leur utilisation est envisagée par un certain nombre de pays en raison du risque pour la santé humaine et des pertes économiques résultant de l'infection du bétail. D'autres méthodes incluent l'utilisation de molluscicides pour réduire le nombre d'escargots qui agissent comme vecteurs, mais ce n'est pas pratique. Il a été démontré que les méthodes éducatives visant à réduire la consommation de cresson sauvage et d'autres plantes aquatiques fonctionnent dans les zones à forte charge de morbidité.
La fasciolose est présente en Europe, en Afrique, dans les Amériques ainsi qu'en Océanie. Récemment, les pertes mondiales de productivité animale dues à la fasciolose ont été estimées de manière prudente à plus de 3,2 milliards de dollars US par an. La fasciolose est désormais reconnue comme une maladie humaine émergente : l' Organisation mondiale de la santé (OMS) a estimé que 2,4 millions de personnes sont infectées par Fasciola , et 180 millions de plus sont à risque d'infection.
Signes et symptômes
Humains

L'évolution de la fasciolose chez l'homme comporte 4 phases principales :
- Phase d' incubation : de l'ingestion des métacercaires à l'apparition des premiers symptômes ; période de temps : quelques jours à 3 mois ; dépend du nombre de métacercaires ingérées et du statut immunitaire de l'hôte
-
Phase invasive ou aiguë : migration de la douve jusqu'aux voies biliaires. Cette phase résulte de la destruction mécanique du tissu hépatique et du péritoine par la migration des douves juvéniles provoquant des réactions toxiques et allergiques localisées et/ou généralisées . Les principaux symptômes de cette phase sont :
- Fièvre : généralement le premier symptôme de la maladie ; 40–42 °C (104–108 °F)
- Douleur abdominale
- Troubles gastro-intestinaux : perte d'appétit, flatulences , nausées , diarrhée
- Urticaire
- Symptômes respiratoires (très rares) : toux , dyspnée , douleur thoracique, hémoptysie
- Hépatomégalie et splénomégalie
- Ascite
- Anémie
- Jaunisse
- Phase latente : Cette phase peut durer des mois ou des années. La proportion de sujets asymptomatiques dans cette phase est inconnue. Ils sont souvent découverts lors d'un dépistage familial après le diagnostic d'un patient.
- Phase chronique ou obstructive :
Cette phase peut se développer des mois ou des années après l'infection initiale. Les douves adultes dans les voies biliaires provoquent une inflammation et une hyperplasie de l'épithélium. La cholangite et la cholécystite qui en résultent, combinées au corps volumineux des douves, suffisent à provoquer une obstruction mécanique du canal biliaire. Dans cette phase, des voies biliaires coliques , épigastrique la douleur, l' intolérance alimentaire gras, des nausées, ictère, prurit , douleur abdominale droite quadrant supérieur, etc., sont des manifestations cliniques impossibles à distinguer de cholangite , cholécystite et cholelithiasis d'autres origines. L'hypertrophie hépatique peut être associée à une hypertrophie de la rate ou à une ascite. En cas d'obstruction, la vésicule biliaire est généralement hypertrophiée et œdémateuse avec un épaississement de la paroi (Réf : Fascioliase hépatobiliaire : résultats échographiques et tomodensitométriques chez 87 patients pendant la phase initiale et le suivi à long terme. Adnan Kabaalioglu, Kagan Ceken, Emel Alimoglu , Rabin Saba, Metin Cubuk, Gokhan Arslan, Ali Apaydin. AJR 2007, 189 : 824-828). Les adhérences fibreuses de la vésicule biliaire aux organes adjacents sont fréquentes. Les lithiases des voies biliaires ou de la vésicule biliaire sont fréquentes et les calculs sont généralement petits et multiples.
Autres animaux
Les signes cliniques de la fasciolose sont toujours étroitement associés à la dose infectieuse (quantité de métacercaires ingérées). Chez le mouton, hôte définitif le plus courant, la présentation clinique est divisée en 4 types :
- Fasciolose aiguë de type I : la dose infectieuse est supérieure à 5000 métacercaires ingérées. Les moutons meurent subitement sans aucun signe clinique préalable. Ascite , hémorragie abdominale , ictère , pâleur des membranes, faiblesse peuvent être observés chez le mouton.
- Fasciolose aiguë de type II : la dose infectieuse est de 1000 à 5000 métacercaires ingérées. Comme ci-dessus, les moutons meurent mais présentent brièvement une pâleur, une perte de condition et une ascite .
- Fasciolose subaiguë : la dose infectieuse est de 800-1000 métacercaires ingérées. Les moutons sont léthargiques , anémiques et peuvent mourir. La perte de poids est la caractéristique dominante.
- Fasciolose chronique : la dose infectieuse est de 200 à 800 métacercaires ingérées. Développement asymptomatique ou progressif de la mâchoire du flacon et de l'ascite ( œdème ventral ), émaciation, perte de poids.
Dans le sang, une anémie , une hypoalbuminémie et une éosinophilie peuvent être observées dans tous les types de fasciolose. Une élévation des activités des enzymes hépatiques , telles que la glutamate déshydrogénase (GLDH), la gamma-glutamyl transférase (GGT) et la lactate déshydrogénase (LDH), est détectée dans la fasciolose subaiguë ou chronique de 12 à 15 semaines après l'ingestion de métacercaires. L'effet économique de la fasciolose chez les moutons consiste en la mort subite des animaux ainsi qu'en une réduction du gain de poids et de la production de laine. Chez les caprins et les bovins, la manifestation clinique est similaire à celle des ovins. Cependant, la résistance acquise à l' infection par F. hepatica est bien connue chez les bovins adultes. Les veaux sont sensibles à la maladie, mais plus de 1000 métacercaires sont généralement nécessaires pour provoquer une fasciolose clinique. Dans ce cas, la maladie est similaire à celle du mouton et se caractérise par une perte de poids, une anémie, une hypoalbuminémie et (après infection par 10 000 métacercaires) la mort. L'importance de la fasciolose bovine consiste en des pertes économiques causées par la condamnation des foies à l'abattage et des pertes de production en particulier dues à un gain de poids réduit.
Chez les moutons et parfois les bovins, le tissu hépatique endommagé peut être infecté par la bactérie Clostridium C. novyi de type B. La bactérie libère des toxines dans la circulation sanguine, ce qui entraîne ce qu'on appelle la maladie noire . Il n'y a pas de remède et la mort suit rapidement. Comme C. novyi est commun dans l'environnement, la maladie noire se rencontre partout où les populations de douves du foie et de moutons se chevauchent.
Cause

1. Les œufs s'embryonnent dans l'eau 2, les œufs libèrent des miracidies 3, qui envahissent un escargot hôte intermédiaire 4 approprié, y compris les genres Galba, Fossaria et Pseudosuccinea. Chez l'escargot, les parasites subissent plusieurs stades de développement (sporocystes Le numéro 4a, les rédies Le numéro 4b et les cercaires Le numéro 4c). Les cercaires sont libérées de l'escargot 5 et s'enkystent sous forme de métacercaires sur la végétation aquatique ou d'autres surfaces. Les mammifères contractent l'infection en mangeant de la végétation contenant des métacercaires. Les humains peuvent être infectés en ingérant des plantes d'eau douce contenant des métacercaires, en particulier du cresson 6. Après ingestion, les métacercaires s'exkystent dans le duodénum 7 et migrent à travers la paroi intestinale, la cavité péritonéale et le parenchyme hépatique dans les voies biliaires, où elles se développent en adultes 8. Chez l'homme, la maturation des métacercaires en douves adultes prend environ 3 à 4 mois. Les douves adultes (Fasciola hepatica : jusqu'à 30 mm sur 13 mm ; F. gigantica : jusqu'à 75 mm) résident dans les grands canaux biliaires de l'hôte mammifère. Fasciola hepatica infecte diverses espèces animales, principalement des herbivores.
La fasciolose est causée par deux trématodes digénétiques F. hepatica et F. gigantica . Les douves adultes des deux espèces sont localisées dans les voies biliaires du foie ou de la vésicule biliaire . F. hepatica mesure 2 à 3 cm et a une répartition cosmopolite . F. gigantica mesure de 4 à 10 cm de long et la répartition de l'espèce est limitée aux tropiques et a été signalée en Afrique, au Moyen-Orient, en Europe de l'Est et en Asie du Sud et de l'Est. Chez le bétail domestique au Japon, des douves diploïdes (2n = 20), triploïdes (3n = 30) et chimériques (2n/3n) ont été décrites, dont beaucoup se reproduisent par parthénogénétique . En raison de cette classification peu claire, les douves au Japon sont normalement appelées Fasciola spp. Des rapports récents basés sur l' analyse des gènes mitochondriaux ont montré que le japonais Fasciola spp. est plus étroitement apparenté à F. gigantica qu'à F. hepatica . En Inde, une espèce appelée F. jacksoni a été décrite chez les éléphants .
Transmission
L' infection humaine par F. hepatica est déterminée par la présence des escargots hôtes intermédiaires, les animaux herbivores domestiques, les conditions climatiques et les habitudes alimentaires de l'homme. Les moutons, les chèvres et les bovins sont considérés comme les principaux réservoirs animaux . Alors que d'autres animaux peuvent être infectés, ils ne sont généralement pas très importants pour la transmission de maladies humaines. D'autre part, certains auteurs ont observé que les ânes et les porcs contribuent à la transmission de maladies en Bolivie. Chez les animaux sauvages, il a été démontré que le rat péridomestique ( Rattus rattus ) pouvait jouer un rôle important dans la propagation ainsi que dans la transmission du parasite en Corse . En France, le ragondin ( Myocastor ragondins ) a été confirmé en tant que hôte de réservoir sauvage de F. hepatica . Les humains sont infectés par l'ingestion de plantes aquatiques qui contiennent des cercaires infectieuses . Plusieurs espèces de légumes aquatiques sont connues comme vecteurs d'infection humaine. En Europe, Nasturtium officinale (commune cresson ), capucine silvestris , Rorippa amphibien (cresson sauvage), Taraxacum dens Leonis ( pissenlit feuilles), olitoria Valerianella ( la laitue d'agneau ), et Mentha de ( la menthe verte ) ont été signalés comme source d'infections humaines. Dans l'Altiplano nord de la Bolivie, certains auteurs ont suggéré que plusieurs plantes aquatiques telles que le bero-bero (cresson), les algues ( algues ), le kjosco et la tortora pourraient constituer une source d'infection pour l'homme. Étant donné que F. hepatica cercariae s'enkyste également à la surface de l'eau, les humains peuvent être infectés en buvant de l'eau fraîche non traitée contenant des cercaires. En outre, une étude expérimentale a suggéré que les humains consommant des plats de foie crus provenant de foies frais infectés par des douves juvéniles pourraient être infectés.
Hôtes intermédiaires

Les hôtes intermédiaires de F. hepatica sont des escargots d'eau douce de la famille des Lymnaeidae . Les escargots de la famille des Planorbidae agissent très occasionnellement comme hôte intermédiaire de F. hepatica .
Mécanisme
Le développement de l'infection chez l'hôte définitif est divisé en deux phases : la phase parenchymateuse (migratrice) et la phase biliaire. La phase parenchymateuse commence lorsque des douves juvéniles exkystées pénètrent dans la paroi intestinale. Après la pénétration de l'intestin, les douves migrent dans la cavité abdominale et pénètrent dans le foie ou d'autres organes. F. hepatica a une forte prédilection pour les tissus du foie. Occasionnellement, des localisations ectopiques de douves telles que les poumons, le diaphragme , la paroi intestinale, les reins et le tissu sous-cutané peuvent survenir. Lors de la migration des douves, les tissus sont détruits mécaniquement et une inflammation apparaît autour des pistes migratoires des douves. La deuxième phase (la phase biliaire) commence lorsque les parasites pénètrent dans les voies biliaires du foie. Dans les voies biliaires, les douves mûrissent, se nourrissent de sang et produisent des œufs. L'hypertrophie des voies biliaires associée à l'obstruction de la lumière se produit à la suite de lésions tissulaires.
Résistance à l'infection
Les mécanismes de résistance ont été étudiés par plusieurs auteurs chez différentes espèces animales. Ces études peuvent aider à mieux comprendre la réponse immunitaire à F. hepatica chez l'hôte et sont nécessaires au développement d'un vaccin contre le parasite. Il a été établi que les bovins acquièrent une résistance à l'infection d'épreuve par F. hepatica et F. gigantica lorsqu'ils ont été sensibilisés par une infection primaire patente ou abrégée par médicament. La résistance à la fasciolose a également été documentée chez le rat. En revanche, les moutons et les chèvres ne sont pas résistants à la réinfection par F. hepatica . Cependant, il existe des preuves que deux races ovines, en particulier le mouton indonésien à queue fine et le mouton rouge maasai , sont résistantes à F. gigantica .
Diagnostic
La plupart des tests d'immunodiagnostic détecteront l'infection et auront une sensibilité supérieure à 90 % à tous les stades de la maladie. De plus, la concentration en anticorps chute rapidement après le traitement et aucun anticorps n'est présent un an après le traitement, ce qui en fait une très bonne méthode de diagnostic. Chez l'homme, le diagnostic de la fasciolose est généralement réalisé parasitologiquement par la découverte d'œufs de douve dans les selles, et immunologiquement par ELISA et Western blot . Les examens coprologiques des selles seuls ne sont généralement pas adéquats car les humains infectés présentent des présentations cliniques importantes bien avant que des œufs ne soient trouvés dans les selles.
De plus, dans de nombreuses infections humaines, les œufs de douve ne sont souvent pas retrouvés dans les selles, même après de multiples examens fécaux. De plus, les œufs de F. hepatica , F. gigantica et Fasciolopsis buski sont morphologiquement indiscernables. Par conséquent, les méthodes immunologiques telles que ELISA et le transfert d'immunoélectrotransfert lié à une enzyme, également appelé Western blot, sont les méthodes les plus importantes pour le diagnostic de l' infection à F. hepatica . Ces tests immunologiques sont basés sur la détection d' anticorps spécifiques à l'espèce à partir de sérums . Les préparations antigéniques utilisées sont principalement dérivées d'extraits de produits excréteurs/sécréteurs de vers adultes ou de fractions partiellement purifiées. Récemment, indigènes et purifiés recombinants ont été utilisés des antigènes, par exemple recombinant F. hepatica cathepsine L -comme protéase .
Les méthodes basées sur la détection d'antigènes (circulant dans le sérum ou dans les fèces) sont moins fréquentes. De plus, les examens biochimiques et hématologiques des sérums humains permettent le diagnostic exact (éosinophilie, élévation des enzymes hépatiques). L' échographie et rayons X de la cavité abdominale, la biopsie du foie, la vésicule biliaire et ponctuée peut également être utilisé (ref: aspiration de la vésicule biliaire US-guidée:. Un nouveau procédé de diagnostic pour la fasciolase biliaire A. Kabaalioğlu, A. Apaydin, T. Sindel, E. Lüleci. Eur. Radiol. 9, 880±882 (1999). La fausse fasciolose ( pseudofasciolose ) désigne la présence d'œufs dans les selles résultant non d'une infection réelle mais d'une ingestion récente de foies infectés contenant des œufs. Cette situation (avec son risque d'erreur de diagnostic) peut être évité en demandant au patient de suivre un régime sans foie plusieurs jours avant un nouvel examen des selles.
Chez l'animal, le diagnostic intravitale repose principalement sur des examens des selles et des méthodes immunologiques. Cependant, les signes cliniques, le profil biochimique et hématologique, la saison, les conditions climatiques, la situation épidémiologique et les examens des mollusques doivent être pris en compte. Comme pour les humains, les examens des selles ne sont pas fiables. De plus, les œufs de douve sont détectables dans les fèces 8 à 12 semaines après l'infection. Malgré cela, l'examen fécal reste le seul outil de diagnostic utilisé dans certains pays. Alors que le diagnostic coprologique de la fasciolose est possible de 8 à 12 semaines après l'infection (WPI), les anticorps spécifiques de F. hepatica sont reconnus par ELISA ou Western blot après 2-4 semaines après l'infection. Par conséquent, ces méthodes permettent une détection précoce de l'infection.
La prévention
Dans certaines régions, des programmes de contrôle spéciaux sont en place ou ont été planifiés. Les types de mesures de contrôle dépendent du contexte (tels que des facteurs épidémiologiques, écologiques et culturels). Un contrôle strict de la croissance et de la vente du cresson et d'autres plantes aquatiques comestibles est important. Les individus peuvent se protéger en ne mangeant pas de cresson cru et d'autres plantes aquatiques, en particulier dans les zones de pâturage endémiques. Les voyageurs qui se rendent dans des zones où l'assainissement est médiocre doivent éviter les aliments et l'eau qui pourraient être contaminés (viciés). Les légumes cultivés dans les champs, qui pourraient avoir été irrigués avec de l'eau polluée, doivent être soigneusement cuits, de même que les viscères d'animaux potentiellement infectés.
Traitement
Humains
Plusieurs médicaments sont efficaces pour la fasciolase, à la fois chez l'homme et chez les animaux domestiques. Le médicament de choix dans le traitement de la fasciolose est le triclabendazole , un membre de la famille des anthelminthiques benzimidazoles . Le médicament agit en empêchant la polymérisation de la molécule tubuline dans les structures cytosquelettiques , les microtubules . La résistance de F. hepatica au triclabendazole a été signalée en Australie en 1995 et en Irlande en 1998.
Le traitement au praziquantel est inefficace. Il existe des rapports de cas d' utilisation réussie du nitazoxanide dans le traitement de la fasciolose humaine au Mexique. Il existe également des rapports d' utilisation réussie du bithionol .
Le nitazoxanide s'est avéré efficace dans les essais, mais n'est actuellement pas recommandé.
Animaux domestiques
Seuls le clorsulon et l' albendazole sont approuvés pour le traitement des animaux domestiques aux États-Unis, mais les flukicides disponibles utilisés dans le monde entier comprennent également le triclabendazole , le netobimin , le closantel, le rafoxanide , le nitroxynil et l' oxyclozanide ; cependant, cette liste de médicaments disponibles présente certains inconvénients. Le closantel, le nitroxynil et l'oxyclozanide ne sont pas efficaces contre les jeunes douves du foie et ne doivent être utilisés que pour traiter les infections subaiguës et chroniques. Le triclabendazole est efficace pour tuer les douves de tout âge, mais uniquement celles qui causent des infections aiguës; les douves qui sont restées dans le corps pendant de longues périodes deviennent résistantes à ce médicament. Le moment du traitement est essentiel au succès et est déterminé par des facteurs environnementaux et l'analyse de la distribution et de la prévalence attendues de la maladie. Par exemple, dans les pays européens qui ont un grand nombre de moutons, les systèmes informatisés prédisent quand la fasciolose est le plus susceptible d'avoir le plus grand impact sur les populations de moutons et combien de moutons seront le plus susceptibles d'être touchés. Les prédictions dépendent de l'estimation du moment où les conditions environnementales les plus propices à la multiplication des parasites se produiront, telles que la quantité de précipitations, l'évapotranspiration et le rapport des jours humides aux jours secs au cours d'un mois donné. Si des infections graves sont attendues, le traitement des moutons doit commencer en septembre/octobre, puis à nouveau en janvier/février et enfin en avril/mai ; la quantité d'œufs de douve à couver est minime pendant ces périodes car ils nécessitent un environnement chaud et humide, ce qui rend le traitement plus efficace.
Épidémiologie
La fasciolose humaine et animale est présente dans le monde entier. Alors que la fasciolose animale est répandue dans les pays à forte production bovine et ovine, la fasciolose humaine se produit, à l'exception de l'Europe occidentale, dans les pays en développement. La fasciolose ne se produit que dans les zones où existent des conditions favorables pour les hôtes intermédiaires.
Des études menées ces dernières années ont montré que la fasciolose humaine est un problème de santé publique important . La fasciolose humaine a été signalée dans des pays d'Europe, d'Amérique, d'Asie, d'Afrique et d'Océanie. L'incidence des cas humains a augmenté dans 51 pays des cinq continents. Une analyse globale montre que la corrélation attendue entre la fasciolose animale et humaine n'apparaît qu'à un niveau basique. Des prévalences élevées chez l'homme ne sont pas nécessairement trouvées dans les zones où la fasciolose est un grand problème vétérinaire. Par exemple, en Amérique du Sud, on trouve des hyperendémiques et des mésoendémiques en Bolivie et au Pérou où le problème vétérinaire est moins important, tandis que dans des pays comme l'Uruguay, l'Argentine et le Chili, la fasciolose humaine n'est que sporadique ou hypoendémique .
L'Europe
En Europe, la fasciolose humaine se produit principalement en France, en Espagne, au Portugal et dans l'ex-URSS. La France est considérée comme une importante zone d'endémie humaine. Au total, 5863 cas de fasciolose humaine ont été enregistrés dans neuf hôpitaux français de 1970 à 1982. Concernant l'ex-Union soviétique, la quasi-totalité des cas signalés provenaient de la République tadjike . Plusieurs articles faisaient référence à la fasciolose humaine en Turquie. Récemment, une enquête sérologique de la fasciolose humaine a été réalisée dans certaines parties de la Turquie. La prévalence de la maladie a été trouvée sérologiquement à 3,01 % dans la province d'Antalya et entre 0,9 et 6,1 % dans la province d'Isparta , région méditerranéenne de la Turquie. Dans d'autres pays européens, la fasciolose est sporadique et la survenue de la maladie est généralement associée à des déplacements dans des zones d'endémie.
Amériques
En Amérique du Nord, la maladie est très sporadique. Au Mexique, 53 cas ont été signalés. En Amérique centrale, la fasciolose est un problème de santé humaine dans les îles des Caraïbes, en particulier dans les zones de Porto Rico et de Cuba. La province de Pinar del Río et la province de Villa Clara sont des régions cubaines où la fasciolose était hyperendémique. En Amérique du Sud, la fasciolose humaine est un problème grave en Bolivie, au Pérou et en Équateur. Ces pays andins sont considérés comme la zone où la prévalence de la fasciolose humaine est la plus élevée au monde. Les zones hyperendémiques humaines bien connues sont localisées principalement dans la haute plaine appelée altiplano . Dans l'Altiplano nord de la Bolivie, les prévalences détectées dans certaines communautés atteignaient respectivement 72 % et 100 % dans les enquêtes coprologiques et sérologiques . Au Pérou, F. hepatica chez l'homme est présent dans tout le pays. Les prévalences les plus élevées ont été signalées à Arequipa , dans la vallée de Mantaro , dans la vallée de Cajamarca et dans la région de Puno . Dans d'autres pays d'Amérique du Sud comme l'Argentine, l'Uruguay, le Brésil, le Venezuela et la Colombie, la fasciolose humaine semble être sporadique, malgré les fortes prévalences de fasciolose chez les bovins.
Afrique
En Afrique, les cas humains de fasciolose, sauf dans les régions septentrionales, n'ont pas été fréquemment signalés. La prévalence la plus élevée a été enregistrée en Egypte où la maladie est distribuée dans les communautés vivant dans le delta du Nil .
Asie
En Asie, les cas les plus humains ont été signalés en Iran, en particulier dans la province de Gīlān , sur la mer Caspienne . Il a été mentionné que plus de 10 000 cas humains ont été détectés en Iran. En Asie orientale, la fasciolose humaine semble être sporadique. Peu de cas ont été documentés au Japon, en Corée, au Vietnam et en Thaïlande.
Australie et Océanie
En Australie, la fasciolose humaine est très rare (seulement 12 cas documentés). En Nouvelle-Zélande, F. hepatica n'a jamais été détecté chez l'homme.
Autres animaux
Un certain nombre de médicaments ont été utilisés pour contrôler la fasciolose chez les animaux. Les médicaments diffèrent par leur efficacité, leur mode d'action, leur prix et leur viabilité. Les fasciolicides (médicaments contre Fasciola spp.) appartiennent à cinq groupes chimiques principaux :
- Halogénées phénols : bithionol (Bitin), l' hexachlorophène (Bilevon), nitroxynil (Trodax)
- Salicylanilides : closantel (Flukiver, Supaverm), rafoxanide (Flukanide, Ranizole)
- Benzimidazoles : triclabendazole (Fasinex), albendazole (Vermitan, Valbazen), mébendazole (Telmin), luxabendazole (Fluxacur)
- Sulfonamides : clorsulon (Ivomec Plus)
- Phénoxyalcanes : diamphénétide (Coriban)
Le triclabendazole (Fasinex) est considéré comme le médicament le plus courant en raison de sa grande efficacité contre les douves adultes et juvéniles. Le triclabendazole est utilisé pour lutter contre la fasciolose du bétail dans de nombreux pays. Néanmoins, l'utilisation vétérinaire à long terme du triclabendazole a provoqué l'apparition d'une résistance chez F. hepatica . Chez l'animal, la résistance au triclabendazole a été décrite pour la première fois en Australie, puis en Irlande et en Écosse et plus récemment aux Pays-Bas. Compte tenu de ce fait, les scientifiques ont commencé à travailler sur le développement de nouveaux médicaments. Récemment, un nouveau fasciolicide a été testé avec succès sur des bovins infectés naturellement et expérimentalement au Mexique. Ce nouveau médicament est appelé « Compound Alpha » et est chimiquement très similaire au triclabendazole. Pays où la fasciolose chez le bétail a été signalée à plusieurs reprises :
- Europe : Royaume-Uni, Irlande, France, Portugal, Espagne, Suisse, Italie, Pays-Bas, Allemagne, Pologne
- Asie : Turquie, Russie, Thaïlande, Irak, Iran, Chine, Vietnam, Inde, Népal, Japon, Corée, Philippines
- Afrique : Kenya, Zimbabwe, Nigeria, Egypte, Gambie, Maroc
- Australie et Océanie : Australie, Nouvelle-Zélande
- Amériques : États-Unis, Mexique, Cuba, Pérou, Chili, Uruguay, Argentine, Jamaïque, Brésil
Le 8 septembre 2007, les autorités vétérinaires du sud de Cotabato , aux Philippines, ont déclaré que des tests de laboratoire sur des échantillons de vaches, de carabaos et de chevaux dans les 10 villes et la seule ville de la province ont montré un niveau d'infection de 89,5%, une augmentation soudaine des cas positifs parmi gros bétail en raison des conditions météorologiques irrégulières dans la région. Ils doivent être traités immédiatement pour prévenir les complications du surra et les maladies septicémiques hémorragiques . Le surra touchait déjà tous les barangays de la ville de Surallah .
Voir également
Les références
Liens externes
| Classification | |
|---|---|
| Ressources externes |