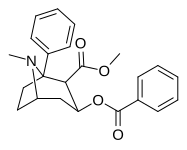
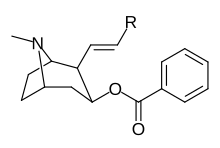
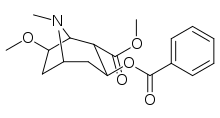
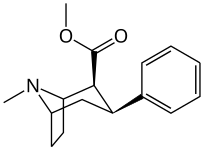
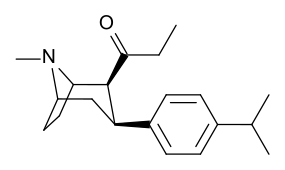
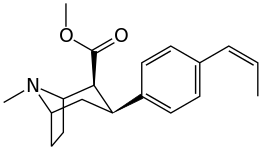
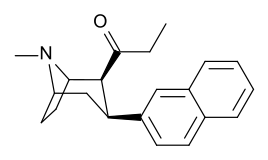
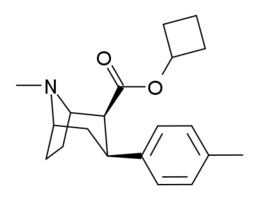
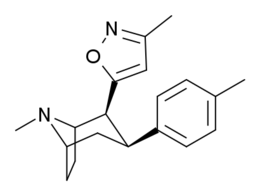
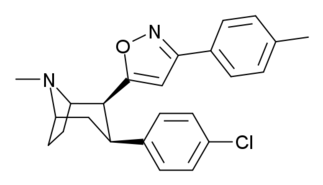
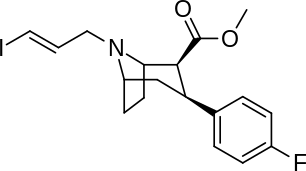
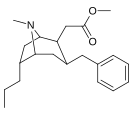
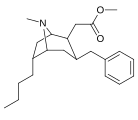
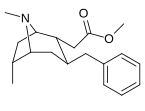
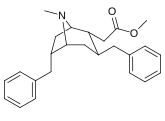
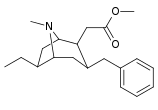
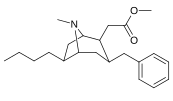
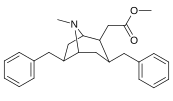
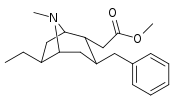
Liste des analogues de la cocaïne - List of cocaine analogues
2′ ( 6′ ) = ortho , 3′ ( 5′ ) = méta & 4′ = para
Ceci est une liste d' analogues de la cocaïne . Un analogue de la cocaïne est une construction (généralement) artificielle d'un nouveau composé chimique à partir (souvent le point de départ de la structure moléculaire naturelle) de la cocaïne, avec le produit résultant suffisamment similaire à la cocaïne pour afficher une similitude, mais une altération de sa fonction chimique. Dans le cadre des composés analogues créés à partir de la structure de la cocaïne, les "analogues de la cocaïne" conservent une fonctionnalité 3 β- benzoyloxy ou similaire (le terme spécifiquement utilisé se distingue généralement des phényltropanes , mais au sens large en général, en tant que catégorie, les inclut ) sur un squelette tropane, par rapport à d'autres stimulants du genre. Bon nombre des analogues semi-synthétiques de la cocaïne proprement dits qui ont été fabriqués et étudiés se composaient des neuf classes de composés suivantes :
- stéréoisomères de la cocaïne
- 3 analogues substitués sur le cycle β- phényle
- 2 β -substitué analogues
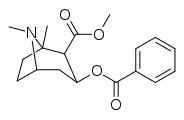
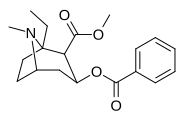
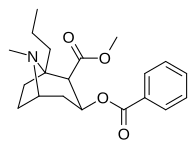
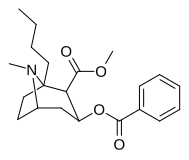
- Analogues N- modifiés de la cocaïne
- 3 analogues β- carbamoyle
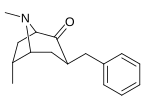
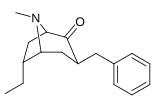
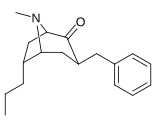
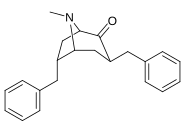
- 3 β -alkyl-3-benzyl tropanes
- Cocaïne 6/7-substituée
- 6-alkyl-3-benzyl tropanes
- homologues pipéridine de la cocaïne
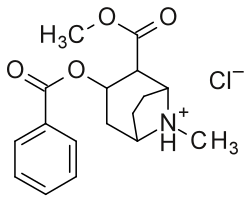
Ci-dessous : Diagramme moléculaire bidimensionnel alternatif de la cocaïne ; montré spécifiquement comme un protoné , NH+, chlorhydrate , et sans tenir compte de la stéréochimie 3D
Cependant, les analogues stricts de la cocaïne incluraient également d'autres combinaisons potentielles telles que les phénacyltropanes et d'autres remplacements à ramifications carbonées non énumérés ci-dessus. Le terme peut également être utilisé de manière vague pour désigner des drogues fabriquées à partir de cocaïne ou ayant pour base une synthèse totale de cocaïne, mais modifiées pour modifier leur effet et QSAR . Ceux-ci comprennent à la fois des anesthésiques bloquants des canaux sodiques intracellulaires et des ligands inhibiteurs stimulants de la recapture de la dopamine (tels que certains, à savoir les pipéridines excisées pontées par tropane ). De plus, les chercheurs ont soutenu des approches combinatoires pour prendre les analogues les plus prometteurs actuellement élucidés et les mélanger jusqu'à la fin de la découverte de composés nouveaux et efficaces afin d'optimiser leur utilisation à différentes fins spécifiées distinctes.

Bien que le carbméthoxy soit indiqué dans sa fonction de liaison hydrogène dans cette représentation, il a été découvert que ce sont principalement les facteurs électrostatiques qui dominent la liaison dans cet espace de la surface moléculaire par rapport au principe de fonctionnement de la liaison hydrogène.
Analogues sensu stricto
Stéréoisomères de la cocaïne
| Structure | Stéréoisomère | L' assignation
alphanumérique de S. Singh |
IC 50 ( nM ) [ 3 H] WIN 3542 inhibition des membranes striatales du rat Erreur moyenne standard ≤ 5 % dans tous les cas |
Nomenclature IUPAC |
|---|---|---|---|---|

|
R -cocaïne (Erythroxyline) |
102 | méthyl(1R,2R,3S,5S)-3-(benzoyloxy)-8-méthyl-8-azabicyclo[3.2.1]octane-2-carboxylate | |

|
R -pseudococaïne (Delcaine, Depsococaine, Dextrocaine, Isococaine, Psicaine.) |
172 | 15800 | méthyl(1R, 2S ,3S,5S)-3-(benzoyloxy)-8-méthyl-8-azabicyclo[3.2.1]octane-2-carboxylate |

|
R- allococaïne | 173 | 6160 | méthyl(1R,2R, 3R ,5S)-3-(benzoyloxy)-8-méthyl-8-azabicyclo[3.2.1]octane-2-carboxylate |
|
R- allopseudococaïne | 174 | 28500 | méthyl(1R, 2S , 3R ,5S)-3-(benzoyloxy)-8-méthyl-8-azabicyclo[3.2.1]octane-2-carboxylate |

|
S- cocaïne | 175 | 15800 | méthyl (1S, 3R, 4R, 5R) -3- (benzoyl) oxy-8-méthyl-8-azabicyclo [3.2.1] octane- 4 -carboxylate |

|
S- pseudococaïne | 176 | 22500 | méthyl (1S, 3R, 4S , 5R) -3- (benzoyl) oxy-8-méthyl-8-azabicyclo [3.2.1] octane- 4 -carboxylate |

|
S- allococaïne | 177 | 9820 | méthyl (1S, 3S , 4R, 5R) -3- (benzoyl) oxy-8-méthyl-8-azabicyclo [3.2.1] octane- 4 -carboxylate |

|
S- allopseudococaïne | 178 | 67700 | méthyl (1S, 3S , 4S , 5R) -3- (benzoyl) oxy-8-méthyl-8-azabicyclo [3.2.1] octane- 4 -carboxylate |
Il existe huit stéréoisomères de la cocaïne (à l'exclusion des mésomères et des modifications de la partie interne de l'anneau tropane). En raison de la présence de quatre atomes de carbone asymétriques dans le pont de liaison en position 1 et 5 à 8 (N) qui pourraient adopter des configurations R et S , la cocaïne peut être considérée comme ayant jusqu'à seize stéréoisomères. Cependant, les contraintes géométriques conférées par l'amine tête de pont ne permettent d'en créer que huit.
L'isomérie naturelle de la cocaïne est instable et sujette à l' épimérisation . Par exemple, le produit final de la biosynthèse de la cocaïne contient une fraction axiale C2-carbométhoxy qui subit facilement une épimérisation jusqu'à la position équitoriale par saponification .
Pour tous les diagrammes structurels 2D où la stéréochimie n'est pas indiquée, il faut supposer que l'analogue représenté partage la conformation stéréochimique de la R- cocaïne, sauf indication contraire.
Arène benzène-cycle 2′, 3′, 4′ (5′ & 6′ ) substitutions de position ( aryle )
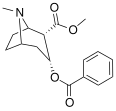
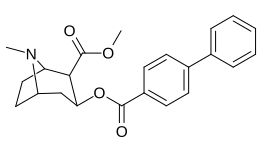
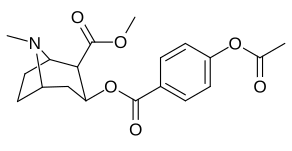
benzoylméthylecgonines para- substituées
| 183a | 183b | 183c |
|---|---|---|
 |
 |
|
| 183d | 4'-Fluorococaïne | P-ISOCOC |
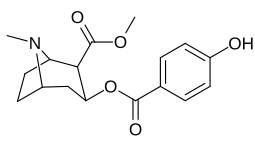 |
 |

|
| Structure | S. Singh alphanumérique assignation (nom) |
4′= R | DAT
[ 3 H] GAGNER 35428 |
5-HTT
[ 3 H]Paroxétine |
RAPPORTER
[ 3 H] Nisoxétine |
Sélectivité
5-HTT/DAT |
Sélectivité
NET/DAT |
|---|---|---|---|---|---|---|---|
| Cocaïne | H | 249 ± 37 | 615 ± 120 | 2500 ± 70 | 2.5 | 10,0 | |
|
non-benzoyloxy analogue ligands comparative non-tropane analogue ligands comparative |
11b (WIN 35428) (nisoxétine) (fluoxétine) |
F — — |
24 ± 4 775 ± 20 5200 ± 1270 |
690 ± 14 762 ± 90 15 ± 3 |
258 ± 40 135 ± 21 963 ± 158 |
28,7 1,0 0,003 |
10,7 0,2 0,2 |

|
|||||||
| 183a | je | 2522 ± 4 | 1052 ± 23 | 18458 ± 1073 | 0,4 | 7.3 | |
| 183b | Ph | 486 ± 63 | - | - | - | - | |
| 183c | OAc | 144 ± 2 | - | - | - | - | |
| 183d | OH | 158 ± 8 | 3104 ± 148 | 601 ± 11 | 19,6 | 3.8 | |
| ( 4′-Fluorococaïne ) | F | - | - | - | - | - | |
| ( ester méthylique de para -isothiocyanatobenzoylecgonine ) ( p -Isococ) |
SNC | - | - | - | - | - |
La poche de liaison MAT analogue à la place lipophile sur les composés de type cocaïne, y compris le cycle benzénique, a une longueur approximative de 9 Â . Ce qui n'est que légèrement plus grand qu'un cycle phényle en lui-même.
benzoylméthylecgonines méta- substituées
| 184a | 184b | m-ISOCOC | C3-Benzyloxycocaïne |
|---|---|---|---|
 |
 |
 |

|
| Structure | S. Singh alphanumérique assignation (nom) |
3′=R | DAT
[ 3 H] GAGNER 35428 |
5-HTT
[ 3 H]Paroxétine |
RAPPORTER
[ 3 H] Nisoxétine |
Sélectivité
5-HTT/DAT |
Sélectivité
NET/DAT |
|---|---|---|---|---|---|---|---|
| (cocaïne) | H | 249 ± 37 | 615 ± 120 | 2500 ± 70 | 2.5 | 10,0 | |
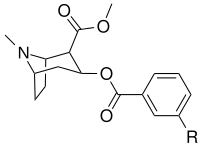
|
|||||||
| 184a | je | 325 ɑ | - | - | - | - | |
| 184b | OH | 1183 ± 115 | 793 ± 33 | 3760 ± 589 | 0,7 | 3.2 | |
| 191 | O Bn | - | - | - | - | - | |
| ( m -Isocoque) | SNC | - | - | - | - | - |
- ɑ Valeur IC 50 pour le déplacement de [ 3 H]cocaïne
benzoylméthylecgonines ortho- substituées
| 185a | 185b | 185c | 185d |
|---|---|---|---|
 |
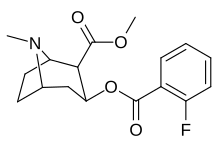 |
 |

|
L'analogue 2′-OH hydroxylé présentait une puissance décuplée par rapport à la cocaïne.
| Structure | S. Singh alphanumérique assignation (nom) |
2′=R | DAT
[ 3 H] GAGNER 35428 |
5-HTT
[ 3 H]Paroxétine |
RAPPORTER
[ 3 H] Nisoxétine |
Sélectivité
5-HTT/DAT |
Sélectivité
NET/DAT |
|---|---|---|---|---|---|---|---|
| Cocaïne | H | 249 ± 37 | 615 ± 120 | 2500 ± 70 | 2.5 | 10,0 | |

|
|||||||
| 185a | je | 350 ɑ | - | - | - | - | |
| 185b | F | 604 ± 67 | 1770 ± 309 | 1392 ± 173 | 2.9 | 2.3 | |
| 185c ( 2′-acétoxycocaïne ) |
OAc | 70 ± 1 | 219 ± 20 | 72 ± 9 | 3.1 | 1,0 | |
| 185d ( 2′-Hydroxycocaïne ) |
OH | 25 ± 4 | 143 ± 21 | 48 ± 2 | 5.7 | 1.9 |
- ɑ Valeur IC 50 pour le déplacement de [ 3 H]cocaïne
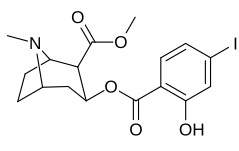
Collecteurs et terminaisons benzoyloxy phényl-substitutions
| Vanillylméthylecgonine | 186b |
|---|---|
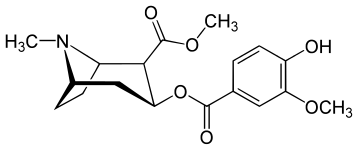 |
|
Les multi-substitutions (substitutions de substitutions ; par exemple meta - & para - ) ou les analogues substitués multiples (« plusieurs fois ») sont des analogues où plus d'une modification de la molécule mère a lieu (ayant de nombreux constituants intermédiaires). Ceux-ci sont créés avec des résultats de relation structure-activité souvent surprenants qui en sont extrapolés. C'est même un cas courant où deux substitutions séparées peuvent chacune donner un composé plus faible, d'affinité plus faible ou même totalement non efficace respectivement ; mais en raison des découvertes qui souvent, lorsqu'elles sont utilisées ensemble, ces deux changements mutuellement inférieurs ajoutés en tandem à un analogue ont le potentiel de faire en sorte que le dérivé résultant affiche une efficacité, une affinité, une sélectivité et/ou une force bien plus grandes que même le composé parent ; qui autrement était compromise par l'une ou l'autre de ces deux alternances lorsqu'elles étaient faites seules.
| Structure | S. Singh alphanumérique assignation (nom) |
ortho -2′= R | méta -3′= R | para -4′= R | DAT
[ 3 H] GAGNER 35428 |
5-HTT
[ 3 H]Paroxétine |
RAPPORTER
[ 3 H] Nisoxétine |
Sélectivité
5-HTT/DAT |
Sélectivité
NET/DAT |
|---|---|---|---|---|---|---|---|---|---|
 |
186 | HO | H | je | 215 ± 19 | 195 ± 10 | 1021 ± 75 | 0,9 | 4.7 |
 |
( Vanillylméthylecgonine ) | H | LCO 3 | OH | - | - | - | - | - |
Modifications des ramifications benzoyle et carbométhoxy
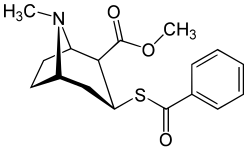
Un soufre à la place de l'oxygène au niveau de la liaison simple de l'ester de benzoyle entraîne une électronégativité inférieure à celle de la cocaïne.

REC est un analogue de la cocaïne qui contient une fraction carbométhoxy C2 « inversée ». Dans les études animales, le REC manquait d'effets stimulants de type cocaïne.
Hydrogène à cycle tropane en C1—substitutions
- ɑ , P < 0,05 par rapport à la (—)-cocaïne (ANOVA unidirectionnelle suivie du test de comparaisons multiples de Dunnett)
- b , P < 0,01 par rapport à la (—)-cocaïne (ANOVA unidirectionnelle suivie du test de comparaisons multiples de Dunnett)
- c La lidocaïne s'est avérée avoir une valeur de 39,6 ± 2,4, la plus faible de toutes les valeurs testées.
- d La même référence donne 25,9 ± 2,4 M pour la (+)-cocaïne et 13,6 ± 1,3 M pour la norcocaïne. Comparativement, il donne 12,7 ± 1,5 µM pour l'affinité sigmaergique de la (+)-amphétamine. Une autre référence donne 1,7-6,7 µM pour la (-)-cocaïne. Toutes les valeurs K i .
-
En utilisant le même ensemble de données que le tableau ci-dessus, les composés suivants se sont avérés comparables :
- CFT @ DAT = 39,2 ± 7,1 (n = 5)
- fluoxétine @ SERT = 27,3 ± 9,2 (n = 3)
- désipramine @ NET = 2,74 ± 0,59 (n = 3)
Analogues de la cocaïne substituant la position du cycle C1-tropane, nécessitant la chimie de la sulfinimine ( N -sulfinyl-imine) (avant l'innovation dont l'innovation était intenable) qui se lient contrairement à la configuration typique à DAT (ouvert vers l'extérieur) comme la cocaïne (avec son terminal D79- distance Y156 de 6,03 ), ou dans la conformation atypique (fermée à extérieure) des benztropines (3,29 ). Bien que plus proches de l'extérieur : (—)-1-méthyl-cocaïne = 4,40 & (—)-1-phényl-cocaïne = 4,89 Å, et présentant une interaction préférentielle avec la conformation DAT tournée vers l'extérieur, ils semblent avoir le manque de stimulation comportementale comme le type fermé à dehors. Bien qu'ils aient des profils comportementaux non stimulants, ils semblent toujours avoir des profils comportementaux antidépresseurs.
L'analogue phényle C1 est dix fois plus puissant que la cocaïne en tant que ligand de la pompe de recapture de la dopamine et vingt-quatre fois plus puissant en tant qu'anesthésique local (bloqueur des canaux Na+ dépendant de la tension), tandis que l'analogue méthylique C1 est 2,3 fois moins puissant en tant qu'anesthésique local.
cf. hydroxytropacocaïne pour un alcaloïde naturel (qui manque cependant du carbméthoxy en position 2) qui est un substituant C1 avec un groupe hydroxy .
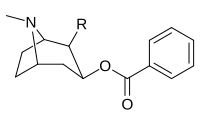
2 β -substitutions
| 196a ( Cocaéthylène ) | 196b | 196c | 196d | 196e |
|---|---|---|---|---|
 |
 |
 |
 |
|
| 196f | 196g | 196h | 196i | 196j |
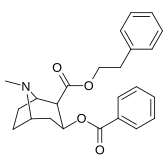 |
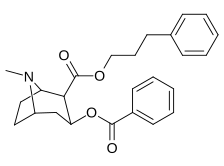 |
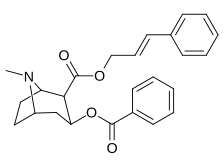 |
 |

|
| 196k | 196l | 196m | 196n | 196o |
 |
 |
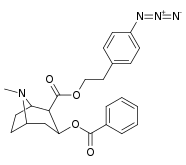 |
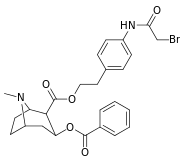 |

|
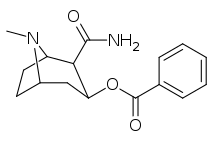
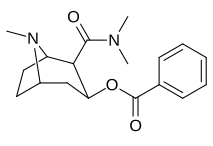
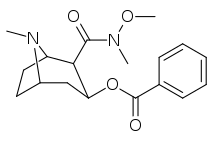
| 197a | 197b | 197c | 197d | 197e |
 |
 |
 |
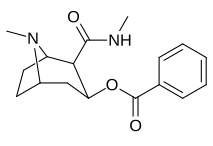 |
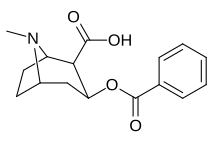
|
| 197f | 197g | |||
 |

|
| Structure | S. Singh alphanumérique assignation (nom) |
R | DAT
[ 3 H] GAGNER 35428 |
5-HTT
[ 3 H]Paroxétine |
RAPPORTER
[ 3 H] Nisoxétine |
Sélectivité
5-HTT/DAT |
Sélectivité
NET/DAT |
|---|---|---|---|---|---|---|---|

|
|||||||
| (Cocaïne) | Moi | 89 ± 4,8 | 1045 ± 89 | 3298 ± 293 | 11.7 | 37,0 | |
| 196a ( Cocaéthylène ) |
Et | 195 ± 45 | 5801 ± 493 | 10000 ± 751 | 29,7 | 51,3 | |
| 196b | n- Pr | 196 ± 46 | 4517 ± 430 | 6124 ± 262 | 23.3 | 31,2 | |
| 196c | je -Pr | 219 ± 48 | 25224 ± 1498 | 30384 ± 1685 | 115 | 139 | |
| 196d | Ph | 112 ± 31 | 33666 ± 3330 | 31024 ± 1909 | 300 | 277 | |
| 196e | Bn | 257 ± 14 | 302 ± 23 | 20794 ± 950 | 1.2 | 80,9 | |
| 196f | -phénéthyle | 181 ± 10 | 615 ± 52 | 19944 ± 1026 | 3.4 | 110 | |
| 196g | -phénylpropyle | 147 ± 19 | 374 ± 15 | 4893 ± 344 | 2.5 | 33,3 | |
| 196h | cinnamyle | 371 ± 15 | 368 ± 6,3 | 68931 ± 3476 | 1,0 | 186 | |
| 196i | p -NO 2 -β-phénéthyle | 601 ± 28 | - | - | - | - | |
| 196j | p -Cl-β-phénéthyle | 271 ± 12 | - | - | - | - | |
| 196k | p -NH 2 -β-phénéthyle | 72 ± 7 | - | - | - | - | |
| 196l | p - NCS -β-phénéthyle | 196 ± 14 | - | - | - | - | |
| 196m | p - azido -β-phénéthyle | 227 ± 19 | - | - | - | - | |
| 196n | ( p -NHCOCH 2 Br)β-phénéthyle | 61 ± 6 | - | - | - | - | |
| 196o | ( p -NHCO(CH 2 ) 2 CO 2 Et)β-phénéthyle | 86 ± 4 | - | - | - | - | |
 |
197a | NH 2 | 753 ± 41,3 | 13725 ± 1256 | 3981 ± 229 | 18.2 | 5.3 |
| 197b | -NMe 2 | 127 ± 6,36 | 143713 ± 8854 | 7329 ± 158 | 1131 | 57,7 | |
| 197c | -N(OMe)Moi | 60 ± 6,4 | 28162 ± 2565 | 3935 ± 266 | 469 | 65,6 | |
| 197d | -NHMe | 2424 ± 118 | 44798 ± 2105 | 4213 ± 206 | 18,5 | 1.7 | |
| 197e ( benzoylecgonine ) |
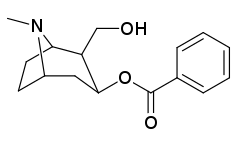
-OH | 195000 | - | - | - | - | |
 |
197f | HOCH 2 - | 561 ± 149 | - | - | - | - |
| 197g ( Tropacocaïne ) |
H | 5180 ± 1160 | - | - | - | - |
Les composés 196e-h possèdent une plus grande affinité SERT que la cocaïne, mais possèdent des affinités NET/DAT plus faibles (à l'exception de 196g à NET). Les composés 196k , 196n , 196o et 197c possèdent tous une plus grande affinité DAT que la cocaïne. Le composé 197b (diméthylamide) présentait une sélectivité d'affinité 1 131 fois plus élevée que le transporteur de sérotonine, avec seulement de légères réductions de puissance pour les transporteurs de dopamine et de noradrénaline. Alors que le 197c ( amide de Weinreb , N-méthoxy-N-méthylamide) avait une augmentation de 469 fois au SERT , avec une plus grande affinité pour le DAT que la cocaïne et une affinité NET égale . 197b était 137x et 196c 27x moins puissant pour se lier au transporteur de la sérotonine, mais les deux avaient un rapport NET / DAT qui en faisait un meilleur dopaminergique que la cocaïne. La considération selon laquelle des substituants C2 volumineux et volumineux modifieraient la conformation spatiale du système cyclique tropane en déformant la partie pipéridine du système et entraveraient ainsi la liaison semble être sans fondement.
La benzoylecgonine ( 197e ) est le principal métabolite inactif de la cocaïne généré par l'hydrolyse de l'ester méthylique C2. Des études de liaison in vitro indiquent que la benzoylecgonine est environ 2 200 fois moins puissante que la cocaïne au niveau du transporteur de dopamine, probablement en raison de la formation de zwitterions empêchant une forte liaison au DAT. Contrairement aux études in vitro , le manque d'activité observé dans les études in vivo est probablement le résultat d'une pénétration réduite de la barrière hémato-encéphalique plutôt que de la formation d'un zwitterion .
Bioisostère carbométhoxy-ester en position 2 remplacements fonctionnels
| 198a | 198b | 198c | 198d |
|---|---|---|---|
 |
 |
 |

|
| 198e | 199a | 199b | 200 |
 |
 |
 |
|
| Structure | S. Singh alphanumérique assignation (nom) |
R | [ 3 H] Mazindol | [ 3 H]DA | Sélectivité
Adoption/Liaison |
|---|---|---|---|---|---|
| (Cocaïne) | (H) | 580 ± 70 | 570 ± 180 | 1,0 | |
|
|||||
| 198a | H | 520 ± 40 | 260 ± 70 | 0,5 | |
| 198b | CO 2 Et (5′-carboéthoxy-) | 120 ± 10 | 290 ± 40 | 2.4 | |
| 198c | BOC | 2230 ± 220 | 1820 ± 810 | 0,8 | |
| 198d | Ph | 2000 ± 640 | 2920 ± 1620 | 1.5 | |
| 198e | CH=CHCO 2 Moi | 3600 ± 400 | 3590 ± 1180 | 1,0 |
Vinylogue 2 β position a carbométhoxy-ester remplacements fonctionnels
| 201a | 201b | 201c | 201d | 201e |
|---|---|---|---|---|
 |
 |
 |
 |

|
Les composés 201b et 201c étaient significativement plus puissants que la cocaïne tandis que les composés 201a , 201d et 201e étaient significativement moins puissants. Ce résultat indique que la présence d'un accepteur de liaison hydrogène ( c. - à carbométhoxy) en 2 β poste ne soit pas absolument nécessaire pour la création d'analogues de la cocaïne à forte affinité.
| [ 2 H 5 -phényl]-cocaïne | HPBE | [ 2 H 3 -N-méthyl ]-cocaïne | C2-éthyl-OSO 2 CF 2 cocaïne |
2-[(2-méthoxy-2-oxoéthoxy)méthyl] cocaïne |
|---|---|---|---|---|
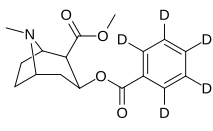 |
![Hydroxypropylbenzoylecgonine (HPBE), qui confère l'effet analgésique topique dans la préparation Esterom.[16]](https://upload.wikimedia.org/wikipedia/commons/thumb/a/af/Hydroxypropyl_benzoylecgonine.svg/171px-Hydroxypropyl_benzoylecgonine.svg.png) |
 |
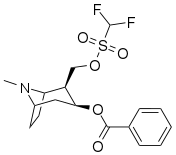 |
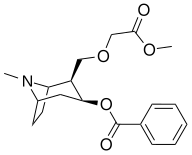
|
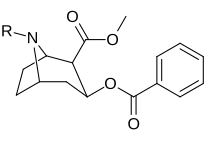
N- modifications
| Norcocaïne (218) | 219a | 219b | 219c |
|---|---|---|---|
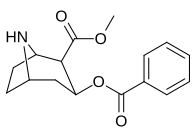 |
 |
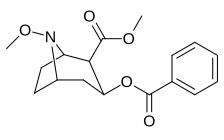 |

|
| 219d | 219e | 220a | 220b |
 |
 |
 |

|
| 220c | 220j | 220e | 220f |
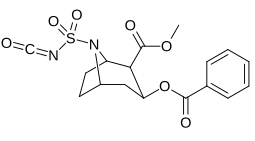 |
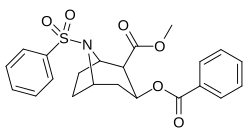 |
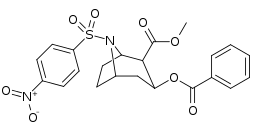 |

|
| 221a | 221b | 221c | 221d |
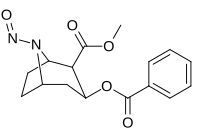 |
 |
 |
|
| Composé | S. Singh alphanumérique assignation (nom) |
N 8- R | [ 3 H] mazindol liaison |
[ 3 H] DA absorption |
Sélectivité
Adoption/Liaison |
|---|---|---|---|---|---|
 |
217 (méthiodure de cocaïne) |
- | 10700 ± 1530 ɑ | - | - |
 |
(Cocaïne) | CH 3 | 280 ± 60 102 ɑ |
320 ± 10 | 1.1 |
| 218 ( Norcocaïne ) |
H | 303 ± 59 ɑ | - | - | |
| 219a | Bn | 668 ± 67 ɑ | - | - | |
| 219b | c.a. | 3370 ± 1080 ɑ | - | - | |
| 219c | CH 2 CH 2 OH | 700 ± 100 | 1600 ± 200 | 2.3 | |
| 219d | CH 2 CO 2 CH 3 | 480 ± 40 | 1600 ± 100 | 3.3 | |
| 219e | CH 2 CO 2 H | 380 ± 20 | 2100 ± 400 | 5.5 | |
| 220a | SO 2 CH 3 ( Ms ) | 1290 ± 80 | 1970 ± 70 | 1.5 | |
| 220b | SO 2 CF 3 ( Tf ) | 330 ± 30 | 760 ± 20 | 2.3 | |
| 220c | SO 2 sous-officier | 120 ± 10 | 160 ± 10 | 1.3 | |
| 220j | SO 2 Ph | 20800 ± 3500 | 61000 | 2.9 | |
| 220e | SO 2 C 6 H 4 -4-NO 2 ( nosyle ) | 5720 ± 1140 | 18800 ± 90 | 3.3 | |
| 220f | SO 2 C 6 H 4 -4-OCH 3 | 6820 ± 580 | 16400 ± 1400 | 2.4 | |
| 221a | NON | 99500 ± 12300 | 231700 ± 39500 | 2.3 | |
| 221b | NON 2 | 7500 ± 900 | 21200 ± 600 | 2.8 | |
| 221c | NHCOCH 3 | >1000000 | >1000000 | - | |
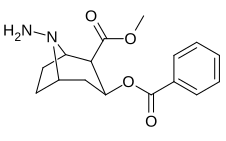
| 221d | NH 2 | - | - | - |
- ɑ IC 50 (nM) pour le déplacement de [ 3 H]WIN 35428
| N 6 Régioisomère | N 7 Régioisomère | ortho- phényl N 7 régioisomère | 8-Oxa cocaïne (cf Meltzer avec PTs ) |
|---|---|---|---|
 |
 |
 |

|
Analogues tricycliques de la cocaïne
8 à 2 analogues captifs
Voir phényltropanes pontés N- avant et arrière .
| Composé | L' assignation
alphanumérique de S. Singh |
[ 3 H] Mazindol | [ 3 H]DA | Sélectivité
Adoption/Liaison |
|---|---|---|---|---|
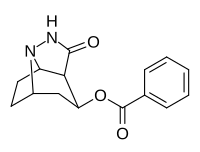 |
222 | 44900 ± 6200 | 115000 ± 15700 | 2.6 |
Les analogues de la cocaïne pontés en arrière sont considérés comme plus proches des analogues de la cocaïne non attachés et des dérivés du phényltropane (où la paire isolée d' azote n'est ni fixée ni contrainte ) et imite mieux leurs affinités. Cela est dû au fait que lorsque la huitième position du tropane de carbone peut tourner librement et qu'elle n'est pas liée, elle occupe de préférence la position axiale définissant son état le moins énergétique et le plus libre. Dans les analogues à pont avant, la fixité rigide des appariements solitaires d'azote le fait résider dans une position équatoriale pour la partie du cycle pipéridine du noyau tropane, pointant vers la tête de pont à deux unités de carbone et trois unités de méthylène ; donnant la préférence aux analogues de la cocaïne pontés avant attestés pour le SERT par rapport au DAT.
8 à 3 analogues captifs
- " N/T " = " non testé "
Analogues de contraction du cycle du tropane (azabornane)
Analogues de la méthoxycocaïne et de la méthoxypseudococaïne en position tropane 6/7
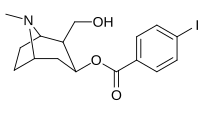
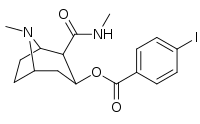
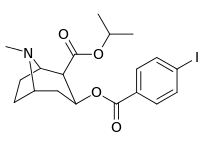
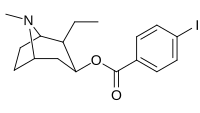
Analogues de combinaison 3 β -position 2′—(6′) & 2 β -substitution
| 211a | 211b | 211c | 211d | 211e |
|---|---|---|---|---|
 |
 |
 |
 |
|
| 211f | 211g | 211h | 211i | 211j |
 |
 |
 |
 |
|
- ɑ Pour le déplacement de [ 3 H]paroxetine (5-HTT & NET)
- b Pour le déplacement de la [ 3 H]nisoxétine (5-HTT & NET)
Analogues 3 β -Carbamoyle
| 223a | 223b | 223c |
|---|---|---|
 |
 |

|
| 223d | 223e | 223f |
 |
 |

|
| 223g | 223h | 223i |
 |
 |

|
Substitutions de liaison phényle en position 3
Voir : Liste des phényltropanes (De nombreux phényltropanes sont dérivés de métabolites de la cocaïne, tels que la méthylecgonidine , en tant que précurseurs . Alors que des méthodes entièrement synthétiques ont été conçues à partir du matériau de départ des vinylcarbénoïdes et des pyrroles.)
La différence de longueur de la liaison benzoyloxy et phényle contrastée entre la cocaïne et les phényltropanes réduit la distance entre le centroïde du benzène aromatique et le pont azote du tropane dans ces derniers PT. Cette distance étant sur une échelle de 5,6 Å pour phenyltropanes et 7,7 Å pour la cocaïne ou analogues avec le intact benzoyloxy. Cela peut expliquer le profil de stimulation comportementale accru des PT par rapport à la cocaïne. Les différences de pouvoir de liaison ont également été expliquées en tenant compte des effets de solvatation ; la cocaïne contenant 2 groupes β ,3 β -ester étant calculée comme étant plus solvatée que les composés de type WIN (c'est-à-dire le troparil). Supérieur p K de les s de l'azote du tropane (8,65 pour la cocaïne, 9,55 pour troparil et 11.95 pour analogique vinyle 43a ), une diminution de solvatation aqueuse et diminution de la flexibilité conformationnelle ajoutée à une affinité de liaison accrue.
Malgré l'observation d'une stimulation accrue, les phényltropanes n'ont pas l'effet de blocage des canaux sodiques anesthésiques locaux que le benzoyloxy confère à la cocaïne. Outre l'effet topique, cela donne à la cocaïne une affinité pour se lier à des sites sur les zones de transport dépendantes de la dopamine et de la sérotonine sodique qui sont distinctes et spécifiques à MAT contrairement aux canaux sodiques généraux ; créer un mécanisme séparé d'affinité relationnelle avec les transporteurs en plus de son inhibition de la recapture pour ces transporteurs ; ceci est unique à la valeur anesthésique locale de la cocaïne et des analogues avec un substitut similaire pour le benzoyloxy qui laisse intacte la capacité de blocage des canaux sodiques. Le fait de rendre ces composés fonctionnels différents dans leur relation avec le MAT contrastait avec les analogues du phényltropane dont le pont anesthésique local a été supprimé. (Exigeant que certains des ions sodium soient pompés de l'axone via Na+/K+-ATPase ). De plus, il a même été postulé qu'un rôle crucial concernant l'énergie électronique conférée via la sensibilisation au voltage (et donc le blocage du potentiel d'action avec une molécule capable de croiser son canal spécifique, dans le cas de la cocaïne un canal sodique , qui sert potentiellement à re -quantifier sa charge) sur un site de liaison au récepteur peut atténuer l'influence médiatrice de la régulation inhibitrice jouée par les autorécepteurs en ralentissant la libération de neurotransmetteurs lorsqu'un efflux est créé par une instance d'agonisme par un composé ; permettre que ledit écoulement se poursuive sans que le corps essaie de maintenir l' homéostasie d' une manière aussi réactive à son changement de conformation.
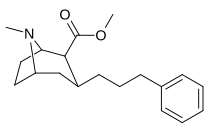
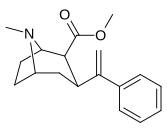
3 β -Alkylphényltropane & 3 β -Alcényles analogues
| 224a | 224b | 224c | 224d | 224e |
|---|---|---|---|---|
 |
 |
 |
 |

|
Le composé 224e , le 3 β analogue -styrène, avait la puissance la plus élevée dans son groupe. Alors que 224b et 224c ont montré la plus grande sélectivité, 224b ayant une puissance dix fois plus grande pour le transporteur de dopamine que la cocaïne.
Analogues du 6-alkyl-3-benzyltropane
| Composé | S. Singh alphanumérique attribution (nom / WIN numéro) |
R | K i (nM) [ 3 H] WIN 35428 liaison |
IC 50 (nM) [ 3 H] DA absorption |
Sélectivité
absorption/liaison |
|---|---|---|---|---|---|
| Cocaïne | 32 ± 5 338 ± 221 |
405 ± 91 405 ± 91 |
12,6 1,2 |
||
| GAGNER 35065-2 | 33 ± 17 314 ± 222 |
373 ± 10 | 11.3 | ||

|
|||||
| (−)-229a | H | 33 ± 5 | 161 ± 100 | 4.9 | |
| 229a | H | 91 ± 10 | 94 ± 26 | 1,0 | |
| 229b | Moi | 211 ± 23 | - | - | |
| 229c | Et | 307 ± 28 | - | - | |
| 229d | n- Pr | 4180 ± 418 | - | - | |
| 229e | n- Bu | 8580 ± 249 | - | - | |
| 229f | Bn | 3080 ± 277 | - | - | |

|
|||||
| (+)-230a | H | 60 ± 6 | 208 ± 63 | 3.5 | |
| 230a | H | 108 ± 14 | 457 ± 104 | 4.2 | |
| 230b | Moi | 561 ± 64 | - | - | |
| 230c | Et | 1150 ± 135 | - | - | |
| 230d | n- Pr | 7240 ± 376 | - | - | |
| 230e | n- Bu | 19700 ± 350 | - | - | |
| 230f | Bn | 7590 ± 53 | - | - | |

|
|||||
| 231b | Moi | 57 ± 5 | 107 ± 36 | 1.9 | |
| 231c | Et | 3110 ± 187 | - | - | |
| 231d | n- Pr | 5850 ± 702 | - | - | |
| 231f | Bn | 1560 ± 63 | - | - | |

|
|||||
| 232b | Moi | 294 ± 29 | 532 ± 136 | 1,8 | |
| 232c | Et | 6210 ± 435 | - | - | |
| 232d | n- Pr | 57300 ± 3440 | - | - | |
| 232f | Bn | 3080 ± 277 | - | - | |
| 241 | Bn | 4830 ± 434 | - | - |
NB Les dérivés du benzylidène servent d'intermédiaires de synthèse pour les 6-Alkyl-3-benzyltropanes et n'ont pas été testés pour leur activité biologique. Les composés 237a et 238a sont le même composé car les deux sont le parent de l'une ou l'autre série avec un hydrogène saturé à leur place de substitution respective.
2,3-pyrimidino direct fusionné
ci-dessous : Chalcostrobamine
cf. strobamine (à droite) pour un composé plus efficace comme ci-dessous.
- " NA " = " aucune affinité ", ex . non quantifiable.
Di-hétéro-benzène direct (pyrimidino) 2,3-fusionnés et donc rigidifiés analogues de la cocaïne.
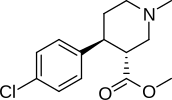
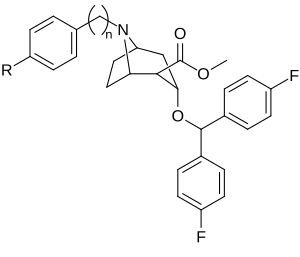
Homologues de la pipéridine cocaïne
cf. phényltropane pipéridine-homologues pour les composés avec une conformation plus optimisée qui donnent des affinités plus élevées lors de la liaison à MAT.
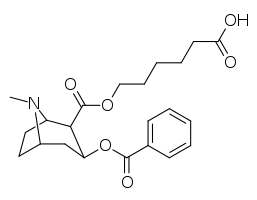
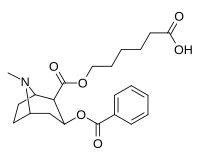
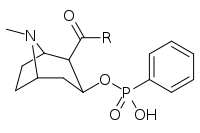
Analogues de l' haptène de la cocaïne
- ɑ Acide 6-(2R,3S)-3-(benzoyloxy)-8-méthyl-8-azabicyclo [3.2.1] octane-2-carbonyloxy-hexanoïque
- b Acide 6-(2R,3S)-3-(benzoyloxy)-8-méthyl-8-azabicyclo [3.2.1] octane-2-carboxamido-hexanoïque
Les haptènes de cocaïne qui créent des anticorps catalytiques nécessitent des états de transition tels qu'ils sont affectés in vivo . Les anticorps monoclonaux générés contre le 402e couplé à la BSA ont accéléré le taux d'hydrolyse de la cocaïne d'environ 23 000 fois et ont éliminé les effets de renforcement de l'administration de cocaïne chez le rat.
| K1-KLH/BSA | K2-KLH/BSA |
|---|---|
 |

|
Analogues intermédiaires structurels/fonctionnels
Analogues de la pipéridine
- JZ-IV-10 (un " hybride Modafinil " avec de la nocaïne. cf. Liste des analogues du modafinil )
Un événement assez récent parmi les tentatives de folklore moderne qui a traversé le cercle de rumeurs principalement confinées aux universités et aux anecdotes sur la culture populaire a été que la cocaïne est un élément, ou un incrément de molécule de poids ou de charge, etc., loin de la structure moléculaire de du sucre. Bien qu'une telle déclaration soit fausse en tant que prétexte général, il existe une superstructure à base de dextrose qui a une superposition vaguement similaire avec la cocaïne qui est « benzoyl- bêta - D -glucoside ».
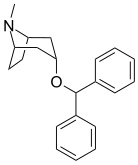
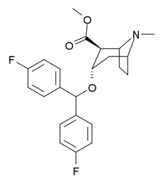
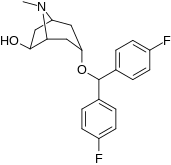
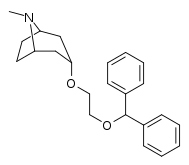
Analogues de la benztropine (3α-diphénylméthoxytropane)
| Benzatropine | Étybenzatropine | Difluoropine (O-620) | PG01053 | 276 | 277 |
|---|---|---|---|---|---|
 |
 |
 |
 |
 |

|
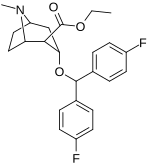
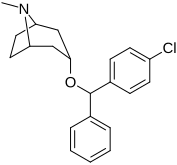
| MFZ 4-86 | MFZ 2-71 | 3-CPMT | JHW 007-d9 | AG 103 | AHN 1-055 |
 |
 |
 |
 |
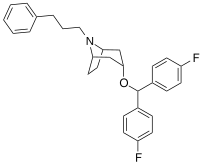 |

|
La liaison des analogues de la benztropine au DAT diffère significativement de celle de la cocaïne et des phényltropanes. Les benztropines sont considérées comme des ligands DAT "atypiques" car elles stabilisent le DAT dans une conformation tournée vers l'intérieur (fermé vers l'extérieur), tandis que la cocaïne et les phényltropanes stabilisent le DAT dans une conformation tournée vers l'extérieur (ouvert vers l'extérieur). . Cette différence de liaison au DAT peut être responsable de l'absence d'effets comportementaux de type cocaïne observés dans les études animales et humaines des analogues de la benztropine et d'autres inhibiteurs « atypiques » du DAT. Des études sur les relations structure-activité de la benztropine ont montré que l'affinité et la sélectivité du DAT par rapport aux autres transporteurs de monoamine sont améliorées par la 4′,4′-difluoration. La modification du substituant n du tropane atténue les effets anticholinergiques des analogues de la benztropine en réduisant l' affinité M1 .
| Composé | S. Singh alphanumérique assignation (nom) |
R | R′ | IC 50 (nM) DAT (Reliure de [ 3 H]WIN 35428) |
IC 50 (nM) 5-HTT (Liaison du [ 3 H]Citalopram) |
Sélectivité 5-HTT/DAT |
|---|---|---|---|---|---|---|
| (benztropine) | 312 ± 1,1 | 24100 ± 14800 | 77,2 | |||
| (GAGNANT 35428) | 12,9 ± 1,1 | 160 ± 20 | 12.4 | |||
| R- 256 | 2040 ± 283 | 1460 ± 255 | 0,7 | |||
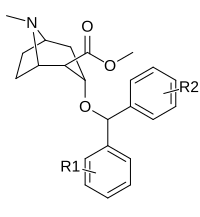
|
||||||
| S -257a | H | H | 33,5 ± 4,5 | 10100 ± 1740 | 301 | |
| S -257b | H | F | 13,2 ± 1,9 | 4930 ± 1200 | 373 | |
|
S -257c (difluoropine) |
F | F | 10,9 ± 1,2 | 3530 ± 1480 | 324 | |
| S -257d | H | Cl | 15,8 ± 0,95 | 5960 ± 467 | 377 | |
| S -257e | Cl | Cl | 91,4 ± 0,85 | 3360 ± 1480 | 36,8 | |
| S -257f | H | Br | 24,0 ± 4,6 | 5770 ± 493 | 240 | |
| S -257g | Br | Br | 72,0 ± 3,65 | 2430 ± 339 | 33,7 | |
| S -257h | H | je | 55,9 ± 10,3 | 9280 ± 1640 | 166 | |
| S -257i | Br | je | 389 ± 29,4 | 4930 ± 82 | 12,7 | |
| S -257j | je | je | 909 ± 79 | 8550 ± 442 | 9.4 | |
| S -257k | H | Moi | 49,5 ± 6,0 | 13200 | 266 | |
| S -257l | Moi | Moi | 240 ± 18,4 | 9800 ± 2680 | 40,8 |
ɑ d' inhibition à 10 pM
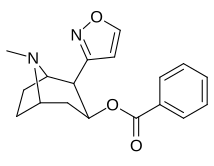
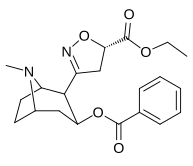
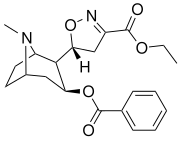
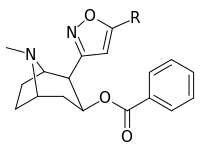
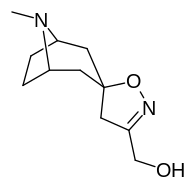
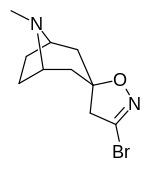
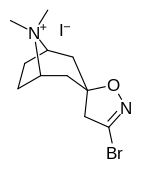
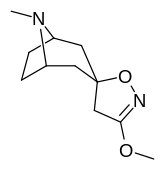
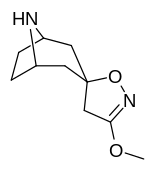
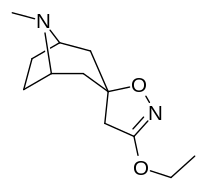
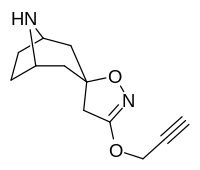
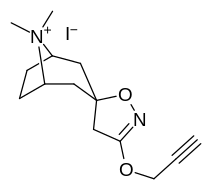
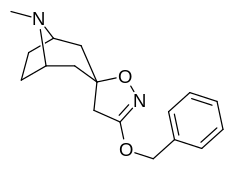
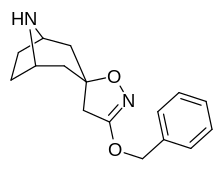
Analogues du tropanyl isoxazoline
| 4a | 4c | 5a | 5c |
|---|---|---|---|
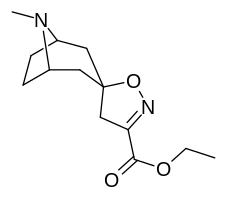 |
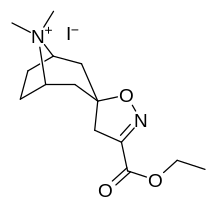 |
 |

|
| 6a | 6b | 6c | 7a |
 |
 |
 |
|
| 7b | 7c | 8a | 8b |
 |
 |
 |

|
| 8c | 9a | 9b | 9c |
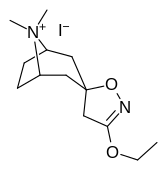 |
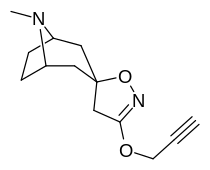 |
 |
|
| 10a | 10b | 10c | 11a |
 |
 |
 |
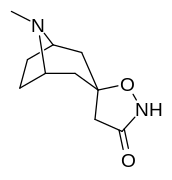
|
| 11b | 12a | 12b | |
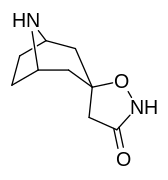 |
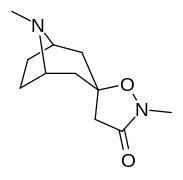 |
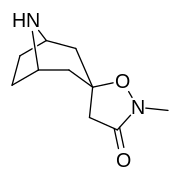
|
Le composé 7a ( 3′-méthoxy-8-méthyl-spiro(8-azabicyclo(3.2.1)octane-3,5′(4′H)-isoxazole ) améliore allostériquement la liaison SERT d'autres ligands de recapture. Composé 7a interprété comme un potentialiser l'effet allostérique (en dévoilant le site du ligand de la zone d'absorption de la sérotonine configuré occlus à la surface du transporteur qui permet la liaison par le ligand exogène, lorsque SERT est autrement conformé d'une manière transitionnelle où un ligand SERT ne peut pas se lier, cet effet avec le composé en question se produit ) à des concentrations de 10μM-30μM (où il agit en interconvertissant l'état conformationnel des SERTs non exposés à ceux exposant le site de liaison des ISRS via un déplacement vers l'équilibre du MAT) tout en exerçant un effet orthostérique inhibiteur lorsque les concentrations atteignent >30μM et au-dessus.
7a est le seul composé connu à moduler allostériquement SERT de cette manière dans des conditions in vitro (il a été démontré que la tianeptine a un effet similaire, mais n'a montré son efficacité que dans des échantillons de tissus vivants in vivo ). son inhibition non compétitive des transporteurs 5-HT diminuant V max avec un petit changement dans le K m pour la sérotonine, stabilisant putativement la conformation faisant face au cytoplasme de SERT : à cet égard, il est considéré comme ayant le profil d'effet opposé de l' ibogaïne, un médicament anti-addiction (sauf pour la fonction à laquelle ses propriétés anti-addictives sont censés être à médiation, à savoir α 3 β 4 blocage du canal nicotinique. cf. 18-Méthoxycornaridine pour une telle activité nicotinergique sans la même affinité SERT).
Le composé 11a possède des effets similaires, mais agit sur le DAT. De même, de telles considérations DAT périphériques (quand, comme c'est souvent le cas, considérées comme conformationnelles plutôt qu'expliquées comme étant électrostatiques) peuvent constituer la différence d'affinité, par occulsion allosertique, entre le cyclopentyl-ruthénium phényltropane dans sa différence avec le tricarbonyl-chrome
Analogues d'amine alicyclique
| EXP-561 | Butyltolylquinuclidine |
|---|---|
 |

|
Dihydroimidazoles
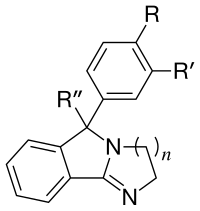
Voir : Liste des analogues du Mazindol
Mazindol est généralement considéré comme un non-habituation (chez l' homme et d'autres mammifères, mais habituant pour par exemple Beagles ) tetracyclic inhibiteur de la recapture de la dopamine (de la classification quelque peu parasite dans l'ancien).
C'est un analogue vaguement fonctionnel utilisé dans la recherche sur la cocaïne ; en grande partie parce que le N- éthylmaléimide est capable d'inhiber environ 95 % de la liaison spécifique du [ 3 H]mazindol aux résidus du ou des sites de liaison MAT, cependant ledit effet de 10 mM de N- éthylmaléimide a été empêché dans son totalité par seulement 10 μ cocaïne M. Considérant que ni 300 μ M dopamine ou D - amphétamine bénéficient d'une protection suffisante pour contraster l'efficacité de la cocaïne.
Anesthésiques locaux (pas habituellement des stimulants du SNC)
Dans les études animales, certains des anesthésiques locaux ont montré des propriétés résiduelles d' inhibiteur de la recapture de la dopamine , bien que normalement celles-ci ne soient pas facilement disponibles. Ceux-ci devraient être plus cardiotoxiques que les phényltropanes. Par exemple, la diméthocaïne a des effets stimulants sur le comportement (et ne sont donc pas énumérés ci-dessous) si une dose de celle-ci est 10 fois supérieure à la quantité de cocaïne. La diméthocaïne est équivalente à la cocaïne en termes d'équivalence anesthésique. Il a été démontré que le "sauvetage" intralipidique inverse les effets cardiotoxiques des inhibiteurs des canaux sodiques et vraisemblablement ces effets lorsqu'ils proviennent également de la cocaïne administrée par voie intraveineuse.
| Nom | Autres noms communs |
|---|---|
| Amylocaïne | Stovaine |
| Articaine | Astracaïne, Carticaïne, Septanest, Septocaïne, Ultracaïne, Zorcaïne |
| Benzocaïne | Anbesol, Lanacane, Orajel |
| Bupivacaïne | Marcaïne, Sensorcaïne, Vivacaïne |
| Butacaïne | Butyn |
| Chloroprocaïne | Nesacaïne |
| Cinchocaïne/Dibucaïne | Cincaïne, Cinchocaïne, Nupercaïnal, Nupercaïne, Sovcaïne |
| Cyclométhycaïne | Surfacaïne, Topocaïne |
| Etidocaine | Duranest |
| Eucaine | α-eucaïne, -eucaïne |
| Fomocaïne | |
| Fotocaïne | |
| Hexylcaïne | Cyclaïne, Osmocaïne |
| Lévobupivacaïne | Chirocaïne |
| Lidocaïne/Lignocaïne | Xylocaïne, Betacaine e |
| Mépivacaïne | Carbocaïne, Polocaïne |
| Méprylcaïne/Oracaïne | Epirocaïne |
| Métabutoxycaïne | Primacaïne |
| Phénacaïne/Holocaïne | Holocaïne |
| Pipérocaïne | Métycaïne |
| Pramocaïne/Pramoxine | Pramoxine |
| Prilocaïne | Citanest |
| Propoxycaïne/Ravocaïne | Pravocaïne, Ranocaïne, Blockaïne |
| Procaïne/Novocaïne | Borocaïne (Procaïne Borate), Éthocaïne |
| Proparacaïne/Alcaïne | Alcaïne |
| Quinisocaïne | Diméthisoquine |
| Risocaïne | Propésine, Propazyl, Propylcaïne |
| Ropivacaïne | Naropin |
| Tétracaïne/Améthocaïne | Pontocaïne, Dicaïne |
| Trimécaïne | Mesdicain, Mesocain, Mesokain |
Voir également

- Les alcaloïdes de la coca , ceux liés à la biosynthèse de la cocaïne comprennent : la benzoylecgonine, l'ecgonidine, l'ecgonine, l'hydroxytropacocaïne, la méthylecgonine cinnamate, la tropacocaïne et la truxilline
- Métabolites de la cocaïne (humains) , qui comprennent : benzoylecgonine (BE), ester méthylique d'ecgonine (EME), ecgonine, norcocaïne, p -hydroxycocaïne, m -hydroxycocaïne, p -hydroxybenzoylecgonine ( p OHBE) et m -hydroxybenzoylecgonine
- Dopaminergiques
- Loi fédérale sur les analogues
- Pharmacophore
- Pharmacopée
- Pharmacocinétique
- Pharmacodynamique
Analogues communs aux D - RAs prototypiques :