Tension superficielle - Surface tension
| Fait partie d'une série sur |
| Mécanique des milieux continus |
|---|

La tension superficielle est la tendance des surfaces liquides au repos à se contracter jusqu'à la surface minimale possible. La tension de surface est ce qui permet aux objets avec une densité plus élevée que l'eau, tels que les lames de rasoir et les insectes (par exemple, les arpenteurs d'eau ) de flotter à la surface de l'eau sans être même partiellement submergés.
Aux interfaces liquide-air, la tension superficielle résulte de la plus grande attraction des molécules liquides entre elles (due à la cohésion ) qu'aux molécules dans l'air (due à l' adhésion ).
Il y a deux mécanismes principaux en jeu. L'un est une force vers l'intérieur sur les molécules de surface provoquant la contraction du liquide. Deuxièmement, une force tangentielle parallèle à la surface du liquide. Cette force tangentielle (par unité de longueur) est généralement appelée tension superficielle. L'effet net est que le liquide se comporte comme si sa surface était recouverte d'une membrane élastique tendue. Mais cette analogie ne doit pas être poussée trop loin car la tension dans une membrane élastique dépend de la quantité de déformation de la membrane alors que la tension superficielle est une propriété inhérente à l' interface liquide - air ou liquide - vapeur.
En raison de l'attraction relativement élevée des molécules d'eau entre elles par un réseau de liaisons hydrogène , l'eau a une tension superficielle plus élevée (72,8 millinewtons (mN) par mètre à 20 °C) que la plupart des autres liquides. La tension superficielle est un facteur important dans le phénomène de capillarité .
La tension superficielle a la dimension de la force par unité de longueur , ou de l' énergie par unité de surface . Les deux sont équivalents, mais lorsqu'on se réfère à l'énergie par unité de surface, il est courant d'utiliser le terme énergie de surface , qui est un terme plus général dans le sens où il s'applique également aux solides .
Dans la science des matériaux , la tension superficielle est utilisée pour soit contrainte de surface ou l' énergie de surface .
Causes
En raison des forces de cohésion, une molécule est tirée également dans toutes les directions par les molécules liquides voisines, ce qui entraîne une force nette de zéro. Les molécules à la surface n'ont pas les mêmes molécules de tous les côtés et sont donc tirées vers l'intérieur. Cela crée une certaine pression interne et force les surfaces liquides à se contracter au minimum.
Il existe également une tension parallèle à la surface à l'interface liquide-air qui résistera à une force externe, en raison de la nature cohésive des molécules d'eau.
Les forces d'attraction agissant entre les molécules de même type sont appelées forces de cohésion tandis que celles agissant entre les molécules de types différents sont appelées forces adhésives. L'équilibre entre la cohésion du liquide et son adhérence au matériau du récipient détermine le degré de mouillage , l' angle de contact et la forme du ménisque . Lorsque la cohésion domine (spécifiquement, l'énergie d'adhésion est inférieure à la moitié de l'énergie de cohésion), le mouillage est faible et le ménisque est convexe au niveau d'une paroi verticale (comme pour le mercure dans un récipient en verre). En revanche, lorsque l'adhérence domine (énergie d'adhérence supérieure à la moitié de l'énergie de cohésion) le mouillage est élevé et le ménisque similaire est concave (comme dans l'eau dans un verre).
La tension superficielle est responsable de la forme des gouttelettes de liquide. Bien que facilement déformées, les gouttelettes d'eau ont tendance à prendre une forme sphérique par le déséquilibre des forces de cohésion de la couche de surface. En l'absence d'autres forces, les gouttes de pratiquement tous les liquides seraient approximativement sphériques. La forme sphérique minimise la "tension de paroi" nécessaire de la couche de surface selon la loi de Laplace .

Une autre façon de voir la tension superficielle est en termes d'énergie. Une molécule en contact avec une voisine est dans un état d'énergie plus faible que si elle était seule. Les molécules intérieures ont autant de voisins qu'elles peuvent en avoir, mais les molécules limites manquent de voisins (par rapport aux molécules intérieures) et ont donc une énergie plus élevée. Pour que le liquide minimise son état énergétique, le nombre de molécules limites d'énergie plus élevée doit être minimisé. Le nombre minimisé de molécules limites se traduit par une surface minimale. En raison de la minimisation de la surface, une surface prendra la forme la plus lisse possible (la preuve mathématique que les formes « lisses » minimisent la surface repose sur l'utilisation de l' équation d'Euler-Lagrange ). Étant donné que toute courbure dans la forme de la surface entraîne une plus grande surface, une énergie plus élevée en résultera également.
Effets de la tension superficielle
L'eau
Plusieurs effets de la tension superficielle peuvent être observés avec de l'eau ordinaire :
- Perles d'eau de pluie sur une surface cireuse, telle qu'une feuille. L'eau adhère faiblement à la cire et fortement à elle-même, de sorte que l'eau se regroupe en gouttes. La tension superficielle leur donne leur forme quasi sphérique, car une sphère a le plus petit rapport surface/volume possible .
- La formation de gouttes se produit lorsqu'une masse de liquide est étirée. L'animation (ci-dessous) montre que l'eau adhérant au robinet gagne de la masse jusqu'à ce qu'elle soit étirée à un point où la tension de surface ne peut plus maintenir la goutte liée au robinet. Il se sépare alors et la tension superficielle forme la goutte dans une sphère. Si un jet d'eau coulait du robinet, le jet se briserait en gouttes lors de sa chute. La gravité étire le courant, puis la tension superficielle le pince en sphères.
- La flottation d'objets plus denses que l'eau se produit lorsque l'objet n'est pas mouillable et que son poids est suffisamment petit pour être supporté par les forces résultant de la tension superficielle. Par exemple, les marcheurs aquatiques utilisent la tension superficielle pour marcher sur la surface d'un étang de la manière suivante. La non mouillabilité de la jambe de l'aquariophile signifie qu'il n'y a pas d'attraction entre les molécules de la jambe et les molécules de l'eau, donc lorsque la jambe appuie sur l'eau, la tension superficielle de l'eau essaie seulement de récupérer sa planéité de sa déformation due à la jambe. Ce comportement de l'eau pousse le strider aquatique vers le haut afin qu'il puisse se tenir à la surface de l'eau tant que sa masse est suffisamment petite pour que l'eau puisse le supporter. La surface de l'eau se comporte comme un film élastique : les pattes de l'insecte provoquent des indentations à la surface de l'eau, augmentant sa surface et la tendance à la minimisation de la courbure de la surface (donc de la surface) de l'eau pousse les pattes de l'insecte vers le haut.
- La séparation de l'huile et de l'eau (dans ce cas, de l'eau et de la cire liquide) est causée par une tension de surface entre des liquides différents. Ce type de tension superficielle est appelé "tension d'interface", mais sa chimie est la même.
- Les larmes de vin sont la formation de gouttes et de ruisseaux sur le côté d'un verre contenant une boisson alcoolisée. Sa cause est une interaction complexe entre les tensions superficielles différentes de l'eau et de l' éthanol ; elle est induite par une combinaison de modification de la tension superficielle de l'eau par l' éthanol avec l'éthanol s'évaporant plus rapidement que l'eau.
C. Les marcheurs aquatiques restent au sommet du liquide à cause de la tension superficielle
D. Lampe à lave avec interaction entre des liquides différents : eau et cire liquide
E. Photo montrant le phénomène des « larmes de vin ».
Tensioactifs
La tension superficielle est visible dans d'autres phénomènes courants, en particulier lorsque des tensioactifs sont utilisés pour la diminuer :
- Les bulles de savon ont de très grandes surfaces avec très peu de masse. Les bulles dans l'eau pure sont instables. L'ajout de tensioactifs peut cependant avoir un effet stabilisant sur les bulles (voir effet Marangoni ). Notez que les tensioactifs réduisent en fait la tension superficielle de l'eau d'un facteur de trois ou plus.
- Les émulsions sont un type de colloïde dans lequel la tension superficielle joue un rôle. De minuscules fragments d'huile en suspension dans de l'eau pure s'assembleront spontanément en des masses beaucoup plus importantes. Mais la présence d'un tensioactif permet une diminution de la tension superficielle, ce qui permet la stabilité de minuscules gouttelettes d'huile dans la masse d'eau (ou vice versa).
La physique
Unités physiques
La tension superficielle, représentée par le symbole γ ( ou σ ou T ), est mesurée en force par unité de longueur . Son unité SI est le newton par mètre mais l' unité cgs de dyne par centimètre est également utilisée. Par exemple,
Croissance de la superficie
La tension superficielle peut être définie en termes de force ou d'énergie.
En termes de force
La tension superficielle γ d'un liquide est la force par unité de longueur. Dans l'illustration de droite, le cadre rectangulaire, composé de trois côtés inamovibles (noir) qui forment un "U", et d'un quatrième côté mobile (bleu) qui peut coulisser vers la droite. La tension superficielle tirera la barre bleue vers la gauche ; la force F nécessaire pour maintenir le côté mobile est proportionnelle à la longueur L du côté immobile. Ainsi le rapport F/Lne dépend que des propriétés intrinsèques du liquide (composition, température, etc.), pas de sa géométrie. Par exemple, si le cadre avait une forme plus compliquée, le rapportF/L, avec L la longueur du côté mobile et F la force nécessaire pour l'empêcher de glisser, s'avère être la même pour toutes les formes. On définit donc la tension superficielle comme
La raison de la 1/2est que le film a deux faces (deux surfaces), dont chacune contribue à parts égales à la force ; donc la force apportée par un seul côté est γL =F/2.
En termes d'énergie
La tension superficielle γ d'un liquide est le rapport entre la variation de l'énergie du liquide et la variation de la surface du liquide (qui a conduit au changement d'énergie). Ceci peut être facilement relié à la définition précédente en termes de force : si F est la force nécessaire pour empêcher le côté de commencer à glisser, alors c'est aussi la force qui maintiendrait le côté en état de glissement à une vitesse constante ( par la deuxième loi de Newton). Mais si le côté se déplace vers la droite (dans la direction où la force est appliquée), alors la surface du liquide étiré augmente pendant que la force appliquée travaille sur le liquide. Cela signifie que l'augmentation de la surface augmente l'énergie du film. Le travail effectué par la force F en déplaçant le côté de la distance Δ x est W = F Δ x ; en même temps , la surface totale du film augmente par Δ A = 2 L Δ x (facteur de 2 est ici parce que le liquide a deux côtés, deux surfaces). Ainsi, en multipliant à la fois le numérateur et le dénominateur de γ =1/2F/Lpar Δ x , on obtient
- .
Ce travail W est, par les arguments usuels , interprété comme étant stocké en énergie potentielle. Par conséquent, la tension superficielle peut également être mesurée dans le système SI en joules par mètre carré et dans le système cgs en ergs par cm 2 . Étant donné que les systèmes mécaniques essaient de trouver un état d'énergie potentielle minimale , une gouttelette de liquide libre prend naturellement une forme sphérique, qui a la surface minimale pour un volume donné. L'équivalence de la mesure de l'énergie par unité de surface à la force par unité de longueur peut être prouvée par une analyse dimensionnelle .
Courbure et pression de surface

Si aucune force n'agit normalement à une surface tendue, la surface doit rester plane. Mais si la pression d'un côté de la surface diffère de la pression de l'autre côté, la différence de pression multipliée par la surface donne une force normale. Pour que les forces de tension superficielle annulent la force due à la pression, la surface doit être courbée. Le diagramme montre comment la courbure de la surface d'une minuscule parcelle de surface conduit à une composante nette des forces de tension superficielle agissant normalement au centre de la parcelle. Lorsque toutes les forces sont équilibrées, l'équation résultante est connue sous le nom d'équation de Young-Laplace :
où:
- Δ p est la différence de pression, connu sous la pression de Laplace .
- γ est la tension superficielle.
- R x et R y sont des rayons de courbure dans chacun des axes parallèles à la surface.
La quantité entre parenthèses à droite est en fait (le double) la courbure moyenne de la surface (selon la normalisation). Les solutions de cette équation déterminent la forme des gouttes d'eau, des flaques d'eau, des ménisques, des bulles de savon et toutes les autres formes déterminées par la tension superficielle (comme la forme des impressions que les pieds d' un arpenteur d'eau font à la surface d'un étang). Le tableau ci-dessous montre comment la pression interne d'une goutte d'eau augmente avec le rayon décroissant. Pour des gouttes pas très petites, l'effet est subtil, mais la différence de pression devient énorme lorsque la taille des gouttes approche de la taille moléculaire. (Dans la limite d'une seule molécule, le concept perd tout son sens.)
| Rayon des gouttelettes | 1 mm | 0,1 mm | 1 m | 10 nm |
|---|---|---|---|---|
| Δ p ( atm ) | 0,0014 | 0,0144 | 1.436 | 143,6 |
Objets flottants
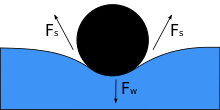
Lorsqu'un objet est placé sur un liquide, son poids F w déprime la surface, et si la tension superficielle et la force vers le bas deviennent égales, ce qui est équilibré par les forces de tension superficielle de chaque côté F s , qui sont chacune parallèles à la surface de l'eau à la points où il entre en contact avec l'objet. Notez que de petits mouvements dans le corps peuvent faire couler l'objet. Lorsque l'angle de contact diminue, la tension superficielle diminue. Les composantes horizontales des deux flèches F s pointent dans des directions opposées, elles s'annulent donc, mais les composantes verticales pointent dans la même direction et s'additionnent donc pour équilibrer F w . La surface de l'objet ne doit pas être mouillable pour que cela se produise, et son poids doit être suffisamment faible pour que la tension superficielle le supporte. Si m désigne la masse de l'aiguille et g l' accélération due à la pesanteur, on a
Surface liquide
Trouver la forme de la surface minimale délimitée par un cadre de forme arbitraire en utilisant des moyens strictement mathématiques peut être une tâche ardue. Pourtant, en façonnant le cadre en fil de fer et en le trempant dans une solution de savon, une surface localement minimale apparaîtra dans le film de savon résultant en quelques secondes.
La raison en est que la différence de pression à travers une interface fluide est proportionnelle à la courbure moyenne , comme le montre l' équation de Young-Laplace . Pour un film de savon ouvert, la différence de pression est nulle, donc la courbure moyenne est nulle, et les surfaces minimales ont la propriété de courbure moyenne nulle.
Angles de contact
La surface de tout liquide est une interface entre ce liquide et un autre milieu. La surface supérieure d'un étang, par exemple, est une interface entre l'eau de l'étang et l'air. La tension superficielle n'est donc pas une propriété du liquide seul, mais une propriété de l'interface du liquide avec un autre milieu. Si un liquide se trouve dans un récipient, outre l'interface liquide/air à sa surface supérieure, il existe également une interface entre le liquide et les parois du récipient. La tension superficielle entre le liquide et l'air est généralement différente (supérieure) de sa tension superficielle avec les parois d'un récipient. Et là où les deux surfaces se rencontrent, leur géométrie doit être telle que toutes les forces s'équilibrent.
Lorsque les deux surfaces se rencontrent, ils forment un angle de contact , θ , qui est l'angle de la tangente à la surface fait avec la surface solide. Notez que l'angle est mesuré à travers le liquide , comme indiqué dans les diagrammes ci-dessus. Le schéma de droite montre deux exemples. Les forces de tension sont indiquées pour l'interface liquide-air, l'interface liquide-solide et l'interface solide-air. L'exemple de gauche est celui où la différence entre la tension superficielle liquide-solide et solide-air, γ ls − γ sa , est inférieure à la tension superficielle liquide-air, γ la , mais est néanmoins positive, c'est-à-dire
Dans le diagramme, les forces verticales et horizontales doivent s'annuler exactement au point de contact, appelé équilibre . La composante horizontale de f la est annulée par la force d'adhérence f A .
L'équilibre des forces le plus révélateur, cependant, est dans la direction verticale. La composante verticale de fl la doit exactement annuler la différence des forces le long de la surface solide, f ls − f sa .
| Liquide | Solide | Angle de contact | |||
|---|---|---|---|---|---|
| l'eau |
|
0° | |||
| éthanol | |||||
| l'éther diéthylique | |||||
| le tétrachlorure de carbone | |||||
| glycérol | |||||
| acide acétique | |||||
| l'eau | paraffine | 107° | |||
| argent | 90° | ||||
| iodure de méthyle | un verre de soda au citron | 29° | |||
| verre au plomb | 30° | ||||
| quartz fondu | 33° | ||||
| Mercure | un verre de soda au citron | 140° | |||
| Quelques angles de contact liquide-solide | |||||
Puisque les forces sont directement proportionnelles à leurs tensions superficielles respectives, on a aussi :
où
- γ ls est la tension de surface liquide-solide,
- γ la est la tension de surface liquide-air,
- γ SA est la tension de surface solide-air,
- θ est l'angle de contact, où une partie concave ménisque a angle de contact inférieur à 90 ° et un ménisque convexe a un angle de contact supérieur à 90 °.
Cela signifie que même si la différence entre la tension de surface liquide-solide et solide-air, gamma ls - γ SA , est difficile à mesurer directement, il peut être déduit de la tension de surface liquide-air, γ la , et l'angle de contact d'équilibre , θ , qui est fonction de l'avancement facilement mesurables et des angles de contact en retrait (voir article principal angle de contact ).
Cette même relation existe dans le diagramme de droite. Mais dans ce cas, nous voyons que parce que l'angle de contact est inférieur à 90°, la différence de tension superficielle liquide-solide/solide-air doit être négative :
Angles de contact spéciaux
Observez que dans le cas particulier d'une interface eau-argent où l'angle de contact est égal à 90°, la différence de tension superficielle liquide-solide/solide-air est exactement nulle.
Un autre cas particulier est celui où l'angle de contact est exactement de 180°. L'eau avec du téflon spécialement préparé s'en approche. Un angle de contact de 180° se produit lorsque la tension superficielle liquide-solide est exactement égale à la tension superficielle liquide-air.
Méthodes de mesure
Parce que la tension superficielle se manifeste par divers effets, elle offre un certain nombre de voies pour sa mesure. La méthode optimale dépend de la nature du liquide mesuré, des conditions dans lesquelles sa tension doit être mesurée et de la stabilité de sa surface lorsqu'elle est déformée. Un instrument qui mesure la tension superficielle est appelé tensiomètre.
- Méthode de l'anneau Du Noüy : La méthode traditionnelle utilisée pour mesurer la tension superficielle ou interfaciale. Les propriétés de mouillage de la surface ou de l'interface ont peu d'influence sur cette technique de mesure. La traction maximale exercée sur l'anneau par la surface est mesurée.
- Méthode de la plaque de Wilhelmy : Une méthode universelle particulièrement adaptée pour contrôler la tension superficielle sur de longs intervalles de temps. Une plaque verticale de périmètre connu est fixée à une balance, et la force due au mouillage est mesurée.
- Méthode Spinning Drop : Cette technique est idéale pour mesurer de faibles tensions interfaciales. Le diamètre d'une goutte dans une phase lourde est mesuré pendant que les deux tournent.
- Méthode de la goutte pendante : La tension superficielle et interfaciale peut être mesurée par cette technique, même à des températures et des pressions élevées. La géométrie d'une goutte est analysée optiquement. Pour les gouttes pendantes, le diamètre maximum et le rapport entre ce paramètre et le diamètre à la distance du diamètre maximum du sommet de la goutte ont été utilisés pour évaluer les paramètres de taille et de forme afin de déterminer la tension superficielle.
- Méthode de la pression des bulles ( méthode de Jaeger) : une technique de mesure pour déterminer la tension de surface à des âges de surface courts. La pression maximale de chaque bulle est mesurée.
- Méthode du volume de goutte : Une méthode pour déterminer la tension interfaciale en fonction de l'âge de l'interface. Un liquide d'une densité est pompé dans un second liquide d'une densité différente et le temps entre les gouttes produites est mesuré.
- Méthode de remontée capillaire : L'extrémité d'un capillaire est immergée dans la solution. La hauteur à laquelle la solution atteint l'intérieur du capillaire est liée à la tension superficielle par l'équation discutée ci-dessous .
 La tension superficielle peut être mesurée en utilisant la méthode de la goutte pendante sur un goniomètre .
La tension superficielle peut être mesurée en utilisant la méthode de la goutte pendante sur un goniomètre . - Méthode stalagmométrique : Méthode de pondération et de lecture d'une goutte de liquide.
- Méthode de la goutte sessile : Méthode de détermination de la tension superficielle et de la densité en plaçant une goutte sur un substrat et en mesurant l' angle de contact (voir Technique de la goutte sessile ).
- Méthode Du Noüy-Padday : Une version réduite de la méthode Du Noüy utilise une aiguille métallique de petit diamètre au lieu d'un anneau, en combinaison avec une microbalance à haute sensibilité pour enregistrer la traction maximale. L'avantage de cette méthode est que de très petits volumes d'échantillons (jusqu'à quelques dizaines de microlitres) peuvent être mesurés avec une très grande précision, sans qu'il soit nécessaire de corriger la flottabilité (pour une aiguille ou plutôt une tige, avec une géométrie appropriée). En outre, la mesure peut être effectuée très rapidement, au minimum en environ 20 secondes.
- Fréquence vibrationnelle des gouttes en lévitation : La fréquence naturelle des oscillations vibrationnelles des gouttes en lévitation magnétique a été utilisée pour mesurer la tension superficielle du 4 He superfluide . Cette valeur est estimée à 0,375 dyn/cm à T = 0 K.
- Oscillations résonantes de gouttes de liquide sphériques et hémisphériques : La technique est basée sur la mesure de la fréquence de résonance de gouttelettes pendantes sphériques et hémisphériques entraînées en oscillations par un champ électrique modulé. La tension superficielle et la viscosité peuvent être évaluées à partir des courbes de résonance obtenues.
- Méthode Drop-Bounce : Cette méthode est basée sur la lévitation aérodynamique avec une conception de buse séparable. Après avoir laissé tomber une gouttelette en lévitation stable sur une plate-forme, l'échantillon se déforme et rebondit, oscillant dans les airs alors qu'il essaie de minimiser sa surface. Grâce à ce comportement d'oscillation, la tension superficielle et la viscosité du liquide peuvent être mesurées.
- Par smartphone : Certains smartphones peuvent être utilisés pour mesurer la tension superficielle d'un liquide transparent. La méthode est basée sur la mesure de la longueur d'onde d'ondes capillaires de fréquence connue. Le smartphone est placé au-dessus d'une tasse avec le liquide. Ensuite, le vibro-moteur du smartphone excite (à travers la tasse) des ondulations capillaires à la surface du liquide, qui sont capturées par l'appareil photo du smartphone.
Effets
Liquide dans un tube vertical
Un baromètre à mercure de style ancien se compose d'un tube de verre vertical d'environ 1 cm de diamètre partiellement rempli de mercure, et avec un vide (appelé vide de Torricelli ) dans le volume non rempli (voir schéma à droite). Notez que le niveau de mercure au centre du tube est plus élevé qu'au niveau des bords, ce qui donne à la surface supérieure du mercure la forme d'un dôme. Le centre de masse de toute la colonne de mercure serait légèrement inférieur si la surface supérieure du mercure était plate sur toute la section transversale du tube. Mais le sommet en forme de dôme donne un peu moins de surface à toute la masse de mercure. Encore une fois, les deux effets se combinent pour minimiser l'énergie potentielle totale. Une telle forme de surface est connue sous le nom de ménisque convexe.
Nous considérons la surface de toute la masse de mercure, y compris la partie de la surface qui est en contact avec le verre, car le mercure n'adhère pas du tout au verre. Ainsi, la tension superficielle du mercure agit sur toute sa surface, y compris là où il est en contact avec le verre. Si au lieu de verre, le tube était en cuivre, la situation serait très différente. Le mercure adhère agressivement au cuivre. Ainsi dans un tube en cuivre, le niveau de mercure au centre du tube sera plus faible qu'aux bords (c'est-à-dire qu'il s'agirait d'un ménisque concave). Dans une situation où le liquide adhère aux parois de son récipient, on considère que la partie de la surface du fluide qui est en contact avec le récipient a une tension superficielle négative . Le fluide travaille alors pour maximiser la surface de contact. Donc, dans ce cas, augmenter la surface en contact avec le conteneur diminue plutôt qu'il n'augmente l'énergie potentielle. Cette diminution est suffisante pour compenser l'augmentation de l'énergie potentielle associée au soulèvement du fluide près des parois du récipient.
Si un tube est suffisamment étroit et que l'adhérence du liquide à ses parois est suffisamment forte, la tension superficielle peut aspirer du liquide dans le tube par un phénomène connu sous le nom d' action capillaire . La hauteur à laquelle la colonne est levée est donnée par la loi de Jurin :
où
- h est la hauteur à laquelle le liquide est soulevé,
- γ la est la tension de surface liquide-air,
- ρ est la densité du liquide,
- r est le rayon du capillaire,
- g est l'accélération due à la pesanteur,
- θ est l'angle de contact décrite ci - dessus. Si θ est supérieur à 90 °, comme le mercure dans un récipient en verre, le liquide va être enfoncée au lieu de levée.
Flaques d'eau sur une surface
Verser du mercure sur une feuille de verre plate horizontale produit une flaque d'eau d' une épaisseur perceptible. La flaque d'eau ne s'étendra que jusqu'à ce qu'elle fasse un peu moins d'un demi-centimètre d'épaisseur, et pas plus. Encore une fois, cela est dû à l'action de la forte tension superficielle du mercure. La masse liquide s'aplatit car cela ramène autant de mercure à un niveau aussi bas que possible, mais la tension superficielle, en même temps, agit pour réduire la surface totale. Le résultat du compromis est une flaque d'épaisseur presque fixe.
La même démonstration de tension superficielle peut être faite avec de l'eau, de l'eau de chaux ou même du sérum physiologique, mais uniquement sur une surface constituée d'une substance à laquelle l'eau n'adhère pas. La cire est une telle substance. L'eau versée sur une surface de cire lisse, plate et horizontale, disons une feuille de verre cirée, se comportera de la même manière que le mercure versé sur le verre.
L'épaisseur d'une flaque de liquide sur une surface dont l'angle de contact est de 180° est donnée par :
où
- h est la profondeur de la flaque en centimètres ou en mètres.
- γ est la tension superficielle du liquide en dynes par centimètre ou newtons par mètre.
- g est l'accélération due à la pesanteur et est égale à 980 cm/s 2 ou 9,8 m/s 2
- ρ est la masse volumique du liquide en grammes par centimètre cube ou en kilogrammes par mètre cube
En réalité, les épaisseurs des flaques seront légèrement inférieures à ce qui est prédit par la formule ci-dessus car très peu de surfaces ont un angle de contact de 180° avec un liquide. Lorsque l'angle de contact est inférieur à 180°, l'épaisseur est donnée par :
Pour le mercure sur le verre, γ Hg = 487 dynes / cm, ρ Hg = 13,5 g / cm 3 et θ = 140 °, ce qui donne h Hg = 0,36 cm. Pour l' eau de paraffine à 25 ° C, γ = 72 dyn / cm, ρ = 1,0 g / cm 3 , et θ = 107 ° , ce qui donne h H 2 O = 0,44 cm.
La formule prédit également que lorsque l'angle de contact est de 0°, le liquide se répandra en une couche micro-mince sur la surface. Une telle surface est dite totalement mouillable par le liquide.
La fragmentation des ruisseaux en gouttes
Dans la vie de tous les jours, nous observons tous qu'un jet d'eau sortant d'un robinet se décompose en gouttelettes, peu importe la fluidité avec laquelle le jet est émis par le robinet. Cela est dû à un phénomène appelé l' instabilité de Plateau-Rayleigh , qui est entièrement une conséquence des effets de la tension de surface.
L'explication de cette instabilité commence par l'existence de petites perturbations dans le cours d'eau. Ceux-ci sont toujours présents, quelle que soit la fluidité du flux. Si les perturbations sont résolues en composantes sinusoïdales , nous constatons que certaines composantes croissent avec le temps tandis que d'autres décroissent avec le temps. Parmi ceux qui croissent avec le temps, certains croissent plus vite que d'autres. Le fait qu'un composant décroisse ou croît, et à quelle vitesse il croît, est entièrement fonction de son nombre d'onde (une mesure du nombre de pics et de creux par centimètre) et des rayons du flux cylindrique d'origine.
Thermodynamique
Théories thermodynamiques de la tension superficielle
JW Gibbs a développé la théorie thermodynamique de la capillarité basée sur l'idée de surfaces de discontinuité. Gibbs a considéré le cas d'une surface mathématique nette placée quelque part dans l'interface physique microscopiquement floue qui existe entre deux substances homogènes. Réalisant que le choix exact de l'emplacement de la surface était quelque peu arbitraire, il la laissa flexible. Depuis l'interface existe en équilibre thermique et chimique avec les substances autour (ayant une température T et potentiels chimiques u i ), Gibbs considéré le cas où la surface peut avoir un excès d' énergie, l' entropie en excès, et l' excès de particules, trouver la fonction d'énergie libre naturelle dans ce cas être , une quantité nommée plus tard comme le grand potentiel et ayant reçu le symbole .
Considérant un sous -volume donné contenant une surface de discontinuité, le volume est divisé par la surface mathématique en deux parties A et B, de volumes et , avec exactement. Or, si les deux parties A et B étaient des fluides homogènes (avec des pressions , ) et restaient parfaitement homogènes jusqu'à la frontière mathématique, sans aucun effet de surface, le grand potentiel total de ce volume serait simplement . Les effets de surface d'intérêt sont une modification à cela, et ils peuvent tous être rassemblés dans un terme d'énergie libre de surface de sorte que le grand potentiel total du volume devient :
Pour des surfaces suffisamment macroscopiques et légèrement incurvées, l'énergie libre de surface doit simplement être proportionnelle à la surface :
pour la tension superficielle et la surface .
Comme indiqué ci-dessus, cela implique que le travail mécanique nécessaire pour augmenter une surface A est dW = dA , en supposant que les volumes de chaque côté ne changent pas. La thermodynamique exige que pour les systèmes maintenus à potentiel chimique et température constants, tout changement spontané d'état s'accompagne d'une diminution de cette énergie libre , c'est-à-dire d'une augmentation de l'entropie totale tenant compte du mouvement possible de l'énergie et des particules de la surface vers les fluides environnants. A partir de là, il est facile de comprendre pourquoi la diminution de la surface d'une masse de liquide est toujours spontanée , à condition qu'elle ne soit pas couplée à d'autres changements d'énergie. Il s'ensuit que pour augmenter la surface, une certaine quantité d'énergie doit être ajoutée.
Gibbs et d'autres scientifiques ont lutté contre l'arbitraire dans le placement microscopique exact de la surface. Pour les surfaces microscopiques avec des courbures très serrées, il n'est pas correct de supposer que la tension de surface est indépendante de la taille, et des sujets comme la longueur de Tolman entrent en jeu. Pour une surface de taille macroscopique (et des surfaces planes), le placement de la surface n'a pas d'effet significatif sur γ mais il a un effet très fort sur les valeurs de l'entropie de surface, des densités de masse en excès de surface et de l'énergie interne de surface, qui sont les dérivées partielles de la fonction de tension superficielle .
Gibbs a souligné que pour les solides, l'énergie libre de surface peut être complètement différente de la contrainte de surface (ce qu'il a appelé la tension de surface) : l'énergie libre de surface est le travail requis pour former la surface, tandis que la contrainte de surface est le travail requis pour étirer la surface. Dans le cas d'une interface à deux fluides, il n'y a pas de distinction entre formage et étirage car les fluides et la surface reconstituent complètement leur nature lorsque la surface est étirée. Pour un solide, l'étirement de la surface, même élastique, entraîne une modification fondamentale de la surface. De plus, la contrainte de surface sur un solide est une quantité directionnelle (un tenseur de contrainte ) tandis que l'énergie de surface est scalaire.
Quinze ans après Gibbs, JD van der Waals a développé la théorie des effets de capillarité basée sur l'hypothèse d'une variation continue de la densité. Il a ajouté à la densité d'énergie du terme où c est le coefficient de capillarité et ρ est la densité. Pour les équilibres multiphasiques , les résultats de l'approche van der Waals coïncident pratiquement avec les formules de Gibbs, mais pour la modélisation de la dynamique des transitions de phase l'approche van der Waals est beaucoup plus pratique. L'énergie de capillarité de van der Waals est maintenant largement utilisée dans les modèles de champ de phase des écoulements polyphasiques. De tels termes sont également découverts dans la dynamique des gaz hors équilibre.
Thermodynamique des bulles
La pression à l'intérieur d'une bulle sphérique idéale peut être dérivée de considérations d'énergie libre thermodynamique. L'énergie libre ci-dessus peut s'écrire :
où est la différence de pression entre l'intérieur (A) et l'extérieur (B) de la bulle, et est le volume de la bulle. A l'équilibre, dΩ = 0 , et donc,
- .
Pour une bulle sphérique, le volume et la surface sont donnés simplement par
et
En substituant ces relations dans l'expression précédente, on trouve
ce qui équivaut à l' équation de Young-Laplace lorsque R x = R y .
Influence de la température
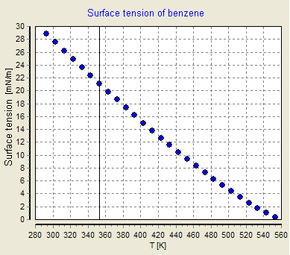
La tension superficielle dépend de la température. Pour cette raison, lorsqu'une valeur est donnée pour la tension superficielle d'une interface, la température doit être explicitement indiquée. La tendance générale est que la tension superficielle diminue avec l'augmentation de la température, atteignant une valeur de 0 à la température critique . Pour plus de détails, voir la règle d'Eötvös . Il n'y a que des équations empiriques pour relier la tension superficielle et la température :
- Eötvös :
Ici, V est le volume molaire d'une substance, T C est la température critique et k est une constante valable pour presque toutes les substances. Une valeur typique est k =2,1 × 10 -7 JK -1 mol - 2 / 3 . Pour l'eau, on peut en outre utiliser V = 18 ml/mol et T C = 647 K (374 °C).
Une variante d'Eötvös est décrite par Ramay et Shields :
où le décalage de température de 6 K fournit à la formule un meilleur ajustement à la réalité à des températures plus basses.
- Guggenheim–Katayama :
γ ° est une constante pour chaque liquide et n est un facteur empirique, dont la valeur est11/9pour les liquides organiques. Cette équation a été également proposée par van der Waals , qui a en outre proposé que γ ° pourrait être donnée par l'expression
où K 2 est une constante universelle pour tous les liquides, et P C est la pression critique du liquide (bien que des expériences ultérieures aient montré que K 2 varie dans une certaine mesure d'un liquide à un autre).
Guggenheim-Katayama et Eötvös prennent tous deux en compte le fait que la tension superficielle atteint 0 à la température critique, alors que Ramay et Shields ne correspondent pas à la réalité à ce point final.
Influence de la concentration de soluté
Les solutés peuvent avoir des effets différents sur la tension superficielle selon la nature de la surface et du soluté :
- Peu ou pas d'effet, par exemple le sucre dans l'eau/l'air, la plupart des composés organiques dans l'huile/l'air
- Augmente la tension superficielle, la plupart des sels inorganiques à eau|air
- Changement non monotone, la plupart des acides inorganiques à eau|air
- Diminuer progressivement la tension superficielle, comme avec la plupart des amphiphiles, par exemple, les alcools à eau|air
- Diminution de la tension superficielle jusqu'à une certaine concentration critique, et aucun effet après : tensioactifs qui forment des micelles
Ce qui complique l'effet, c'est qu'un soluté peut exister à une concentration différente à la surface d'un solvant que dans sa masse. Cette différence varie d'une combinaison soluté-solvant à l'autre.
L'isotherme de Gibbs indique que :
- Γ est connu sous le nom de concentration de surface, il représente l'excès de soluté par unité de surface de surface par rapport à ce qui serait présent si la concentration en vrac prévalait jusqu'à la surface. Il a des unités de mol/m 2
- C est la concentration de la substance dans la solution en vrac.
- R est la constante des gaz et T la température
Certaines hypothèses sont prises dans sa déduction, donc l'isotherme de Gibbs ne peut être appliquée qu'à des solutions idéales (très diluées) à deux composants.
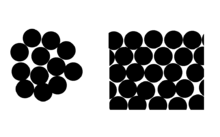
Influence de la taille des particules sur la pression de vapeur
La relation Clausius-Clapeyron conduit à une autre équation également attribuée à Kelvin, comme l' équation de Kelvin . Cela explique pourquoi, à cause de la tension superficielle, la pression de vapeur pour les petites gouttelettes de liquide en suspension est supérieure à la pression de vapeur standard de ce même liquide lorsque l'interface est plate. C'est-à-dire que lorsqu'un liquide forme de petites gouttelettes, la concentration d'équilibre de sa vapeur dans son environnement est plus importante. Cela se produit parce que la pression à l'intérieur de la gouttelette est plus grande qu'à l'extérieur.
- P v ° est la pression de vapeur standard pour ce liquide à cette température et pression.
- V est le volume molaire.
- R est la constante des gaz
- r k est le rayon Kelvin, le rayon des gouttelettes.
L'effet explique la sursaturation des vapeurs. En l'absence de sites de nucléation , de minuscules gouttelettes doivent se former avant de pouvoir évoluer en gouttelettes plus grosses. Cela nécessite une pression de vapeur plusieurs fois supérieure à la pression de vapeur au point de transition de phase .
Cette équation est également utilisée en chimie des catalyseurs pour évaluer la mésoporosité des solides.
L'effet peut être considéré en termes de nombre moyen de voisins moléculaires des molécules de surface (voir diagramme).
Le tableau montre quelques valeurs calculées de cet effet pour l'eau à différentes tailles de gouttes :
| P/P 0pour gouttes d'eau de différents rayons à STP | ||||
|---|---|---|---|---|
| Rayon des gouttelettes (nm) | 1000 | 100 | dix | 1 |
| P/P 0 | 1.001 | 1.011 | 1.114 | 2,95 |
L'effet devient clair pour de très petites tailles de gouttes, car une goutte d'un rayon de 1 nm contient environ 100 molécules, ce qui est une quantité suffisamment petite pour nécessiter une analyse en mécanique quantique .
Tension superficielle de l'eau et de l'eau de mer
Les deux liquides les plus abondants sur Terre sont l' eau douce et l' eau de mer . Cette section donne des corrélations de données de référence pour la tension superficielle des deux.
Tension superficielle de l'eau
La tension superficielle de l'eau liquide pure en contact avec sa vapeur a été donnée par IAPWS comme
où T et la température critique T C = 647,096 K sont exprimés en kelvins . La région de validité de l'ensemble de la courbe de saturation vapeur-liquide, du point triple (0,01 °C) au point critique. Il fournit également des résultats raisonnables lorsqu'il est extrapolé à des conditions métastables (surfusion), jusqu'à au moins -25 °C. Cette formulation a été initialement adoptée par l'IAPWS en 1976 et a été ajustée en 1994 pour se conformer à l'échelle internationale de température de 1990.
L'incertitude de cette formulation est donnée sur toute la plage de température par IAPWS. Pour des températures inférieures à 100 °C, l'incertitude est de ±0,5 %.
Tension superficielle de l'eau de mer
Nayar et al. données de référence publiées pour la tension superficielle de l'eau de mer sur la plage de salinité de 20 ≤ S 131 g/kg et une plage de température de 1 t ≤ 92 °C à pression atmosphérique. La gamme de température et de salinité englobe à la fois la gamme océanographique et la gamme des conditions rencontrées dans les technologies de dessalement thermique . L'incertitude des mesures variait de 0,18 à 0,37 mN/m avec une incertitude moyenne de 0,22 mN/m.
Nayar et al. corrélé les données avec l'équation suivante
où γ sw est la tension superficielle de l'eau de mer en mN/m, γ w est la tension superficielle de l'eau en mN/m, S est la salinité de référence en g/kg et t est la température en degrés Celsius. L'écart absolu moyen en pourcentage entre les mesures et la corrélation était de 0,19 % tandis que l'écart maximal est de 0,60 %.
L'Association internationale pour les propriétés de l'eau et de la vapeur (IAPWS) a adopté cette corrélation comme directive standard internationale.
Tableau de données
| Liquide | Température (°C) | La tension superficielle, γ |
|---|---|---|
| Acide acétique | 20 | 27,60 |
| Acide acétique (45,1%) + Eau | 30 | 40,68 |
| Acide acétique (10,0%) + Eau | 30 | 54,56 |
| Acétone | 20 | 23,70 |
| Du sang | 22 | 55,89 |
| L'éther diéthylique | 20 | 17h00 |
| Éthanol | 20 | 22.27 |
| Ethanol (40%) + Eau | 25 | 29,63 |
| Ethanol (11,1%) + Eau | 25 | 46.03 |
| Glycérol | 20 | 63,00 |
| n- Hexane | 20 | 18.40 |
| Solution aqueuse d' acide chlorhydrique 17,7 M | 20 | 65,95 |
| Isopropanol | 20 | 21,70 |
| Hélium liquide II | −273 | 0,37 |
| L'azote liquide | −196 | 8.85 |
| Oxygène liquide | −182 | 13.2 |
| Mercure | 15 | 487,00 |
| Méthanol | 20 | 22,60 |
| Chlorure d'argent fondu | 650 | 163 |
| Chlorure de sodium fondu / Chlorure de calcium (47/53 % en moles) | 650 | 139 |
| n- octane | 20 | 21,80 |
| Solution aqueuse de chlorure de sodium 6,0 M | 20 | 82,55 |
| Saccharose (55%) + eau | 20 | 76.45 |
| L'eau | 0 | 75,64 |
| L'eau | 25 | 71,97 |
| L'eau | 50 | 67,91 |
| L'eau | 100 | 58,85 |
| Toluène | 25 | 27,73 |
Galerie d'effets
Une bulle de savon équilibre les forces de tension superficielle contre la pression pneumatique interne .
La tension superficielle empêche une pièce de couler : la pièce est incontestablement plus dense que l'eau, elle doit donc déplacer un volume supérieur au sien pour que la flottabilité équilibre la masse.
Voir également
- Anti-buée
- Onde capillaire — ondes courtes à la surface de l'eau, régies par la tension superficielle et l'inertie
- Effet Cheerio - la tendance des petits objets flottants mouillables à s'attirer les uns les autres.
- Cohésion
- Nombres sans dimension
- Banque de données de Dortmund — contient des tensions superficielles expérimentales dépendantes de la température
- Force d'électrodéposition
- Électromouillage
- Électrocapillarité
- Règle d'Eötvös - une règle pour prédire la tension superficielle en fonction de la température
- Tuyau de fluide
- Équilibre hydrostatique - l'effet de la gravité tirant la matière dans une forme ronde
- Interface (chimie)
- Ménisque — courbure de surface formée par un liquide dans un récipient
- Cœur battant de mercure - une conséquence d'une tension superficielle non homogène
- Microfluidique
- Technique de la goutte sessile
- Sow-Hsin Chen
- Énergie de surface spécifique — identique à la tension de surface dans les matériaux isotropes.
- Méthode de chute de filature
- Méthode stalagmométrique
- Pression superficielle
- Sciences des surfaces
- Biomimétique de tension superficielle
- Valeurs de tension superficielle
- Tensioactifs — substances qui réduisent la tension superficielle.
- Équation de Szyszkowski — calcul de la tension superficielle des solutions aqueuses
- Larmes de vin - le phénomène induit par la tension superficielle observé sur les côtés des verres contenant des boissons alcoolisées.
- Longueur de Tolman — terme principal dans la correction de la tension superficielle pour les surfaces courbes.
- Mouillage et démouillage
Remarques
- ^ Dans un baromètre à mercure , la surface supérieure du liquide est une interface entre le liquide et un vide contenant quelques molécules de liquide évaporé.
Les références
Liens externes
- Qu'est-ce que la tension superficielle ?
- « Pourquoi la tension superficielle est-elle parallèle à l'interface ? » . Échange de pile physique . Récupéré le 2021-03-19.
- Berry, MV (1971-03-01). « Le mécanisme moléculaire de la tension superficielle ». Enseignement de la physique . 6 (2) : 79-84. doi :10.1088/0031-9120/6/2/001. ISSN 0031-9120.
- Marchand, Antonin ; Weijs, Joost H. ; Snoeijer, Jacco H. ; Andreotti, Bruno (2011-09-26). « Pourquoi la tension superficielle est-elle une force parallèle à l'interface ? » Journal américain de physique . 79 (10) : 999-1008. doi :10.1119/1.3619866. ISSN 0002-9505. arXiv : https://arxiv.org/abs/1211.3854
- Sur la tension superficielle et des cas réels intéressants
- Tensions superficielles de divers liquides
- Calcul des tensions superficielles dépendantes de la température pour certains composants courants
-
Calculateur de tension superficielle pour les solutions aqueuses contenant les ions H + , NH+
4, Na + , K + , Mg 2+ , Ca 2+ , SO2−
4, NON−
3, Cl - , CO2−
3, Br - et OH - . - T. Proctor Hall (1893) Nouvelles méthodes de mesure de la tension superficielle dans les liquides , Philosophical Magazine (série 5, 36 : 385–415), lien de la Biodiversity Heritage Library .
- Le mur de bulles (diaporama audio du National High Magnetic Field Laboratory expliquant la cohésion, la tension superficielle et les liaisons hydrogène)
- C. Pfister : Énergie sans interface. Scholarpedia 2010 (à partir des premiers principes de la mécanique statistique)
- Fondamentaux de la tension superficielle et interfaciale
- Tension superficielle et interfaciale
- "Tension superficielle du mélange de sels fondus". Le Journal de la thermodynamique chimique . 3 (2) : 259-265. Mars 1971. doi : 10.1016/S0021-9614(71)80111-8 .

























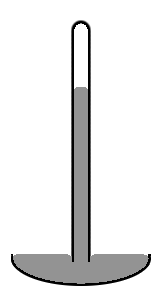







































![{\displaystyle \gamma _{\text{w}}=235.8\left(1-{\frac {T}{T_{\text{C}}}}\right)^{1.256}\left[1-0.625 \left(1-{\frac {T}{T_{\text{C}}}}\right)\right]~{\text{mN/m}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0b65193820b2a29652f19d30a1adecdf0c13c8ea)








