Inhibiteur des récepteurs de l'adénosine diphosphate - Adenosine diphosphate receptor inhibitor
Les inhibiteurs des récepteurs de l' adénosine diphosphate ( ADP ) sont une classe médicamenteuse d' agents antiplaquettaires , utilisés dans le traitement du syndrome coronarien aigu ( SCA ) ou en traitement préventif chez les patients à risque de thromboembolie , d' infarctus du myocarde ou d' accident vasculaire cérébral . Ces médicaments antagonisent lesrécepteurs plaquettaires P2Y 12 et empêchent donc la liaison de l'ADP aurécepteurP2Y 12 . Cela conduit à une diminution de l'agrégation des plaquettes, interdisant la formation de thrombus. LerécepteurP2Y 12 est une protéine liée à la surface que l'on trouve sur les plaquettes sanguines . Ils appartiennent aux récepteurs purinergiques couplés aux protéines G (RCPG) et sont des chimiorécepteurs de l'ADP.
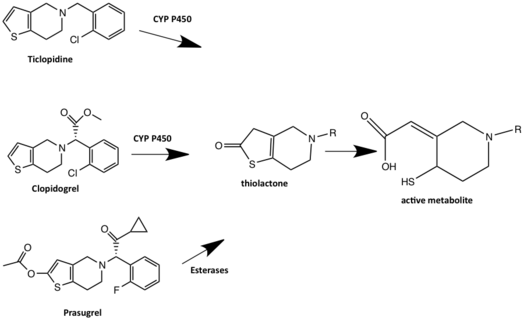
Le premier médicament introduit dans cette classe était la ticlopidine, mais en raison d' effets indésirables, il n'est pas beaucoup utilisé aujourd'hui. La ticlopidine, le clopidogrel et le prasugrel (Efient) sont tous des thiénopyridines qui provoquent une inhibition irréversible du récepteur P2Y 12 . Ce sont tous des promédicaments qui doivent être convertis en un métabolite actif in vivo pour inhiber le récepteur P2Y 12 . D'autre part, de nouveaux médicaments comme le ticagrelor (Brilinta®) et le cangrelor (Kengrexal®) ne sont pas des thiénopyridines et inhibent de manière réversible le P2Y 12, ce qui signifie qu'ils agissent directement sur le récepteur sans nécessiter d'activation métabolique et présentent un début et un décalage d'action plus rapides.
Ces médicaments sont fréquemment administrés en association avec de l' aspirine (acide acétylsalicylique) pour renforcer l'inhibition plaquettaire, en particulier chez les patients atteints de SCA ou subissant une intervention coronarienne percutanée (ICP).
Histoire
Avant l'ère des inhibiteurs de l'ADP, le seul agent antiplaquettaire sur le marché pour traiter les événements antithrombotiques était l'aspirine. Cependant, en raison des événements ischémiques récurrents chez les patients à haut risque, il existait une base pour le développement de médicaments antiplaquettaires pour cibler d'autres voies de signalisation importantes.
L'histoire des inhibiteurs de l'ADP a commencé en 1972 lorsque les chercheurs recherchaient des médicaments similaires à l' agent anti-inflammatoire tinoridine, une thiénopyridine aux effets anti-inflammatoires et analgésiques qui avait été publiée deux ans auparavant. Sur la base de la connaissance de la chimie de la thiénopyridine, un nombre important de dérivés de thiénopyridines ont été synthétisés. Les dérivés ont été testés in-vivo et ex-vivo sur des souris et des rats, mais les résultats des tests n'ont démontré aucun effet anti-inflammatoire ou analgésique, mais ont plutôt montré des effets antiplaquettaires et antithrombotiques inattendus. À cette époque, il était très rare de dépister de nouveaux agents antiplaquettaires, car le lien entre l'agrégation plaquettaire, la thrombose et les incidents cardiovasculaires était contesté. Cependant, le dérivé le plus actif, la ticlopidine, a été sélectionné pour un développement ultérieur. La ticlopidine était la thiénopyridine de première génération qui a amélioré l'inhibition plaquettaire et donc utilisée pour le traitement du syndrome coronarien et d'autres maladies cardiovasculaires. En raison des effets indésirables graves signalés de la ticlopidine, des deuxième et troisième thiénopyridines, du clopidogrel et du prasugrel ont été développés.
Lorsque la ticlopidine et le clopidogrel ont été commercialisés pour la première fois, la ticlodipine en 1978 et le clopidogrel en 1998, le mécanisme d'action de ces deux médicaments antithrombotiques majeurs n'était pas entièrement compris. Ce qui avait été montré, c'était qu'ils étaient de puissants inhibiteurs de l'agrégation plaquettaire induite par l'ADP, mais le récepteur P2Y 12 n'avait pas été identifié. De plus, il était clair que la ticlopidine et le clopidogrel étaient des promédicaments, ce qui signifie qu'ils sont inactifs in vitro et nécessitent donc un métabolisme pour être activé in vivo. Ce n'est qu'en l'an 2000 que les métabolites actifs de ces médicaments ont été isolés et caractérisés. Environ un an plus tard, le récepteur plaquettaire P2Y 12 de l'ADP a été identifié. Suite à ces découvertes, les métabolites actifs et les enzymes responsables de leur formation ont été progressivement identifiés. C'est ainsi plus de 30 ans plus tard après la découverte de la ticlopidine, et plus de 10 ans plus tard après la découverte du clopidogrel, que le mécanisme d'action de ces deux médicaments était expliqué.
Développement
Thiénopyridines
Ticlopidine
Les premiers inhibiteurs de P2Y 12 appartenaient à la famille des thiénopyridines. Ce sont des antagonistes indirects, qui bloquent l'agrégation et l'activation plaquettaires induites par l'ADP. Le premier médicament de cette classe était la ticlopidine et a été découvert en 1972 à Porcor (aujourd'hui Sanofi ). Il a été découvert lors de la recherche d'un nouveau médicament anti-inflammatoire à base de tinoridine. Il a été criblé avec une approche de criblage phénotypique , testé à la fois sur des modèles de rongeurs in vivo et ex vivo . Il a montré une activité antiplaquettaire élevée.
La ticlopidine avait de bonnes promesses et a été sélectionnée pour des essais cliniques. Il a été commercialisé en France en 1978 et s'est mondialisé en 1991 lorsqu'il a atteint le marché américain pour la prévention primaire et secondaire des accidents vasculaires cérébraux.
La recherche d'un autre analogue de la thiénopyridine avec un meilleur rapport activité/ toxicité chez l'animal a commencé dès que la ticlopidine est entrée dans les essais précliniques . Il est devenu plus urgent de trouver un nouvel analogue après des rapports de patients présentant des troubles hématologiques sévères dus à la ticlopidine.
Clopidogrel
Le clopidogrel, une thiénopyridine de deuxième génération, a fait l'objet d'essais précliniques en 1987 et a atteint le marché mondial en 1998. Son mécanisme d'action et celui de son précurseur, la ticlopidine, étaient encore inconnus. Les seules choses qui étaient connues étaient qu'il s'agissait de promédicaments car ils ne montraient aucune activité in vitro, qu'ils affectaient les plaquettes de manière irréversible en raison de leur longue durée d'action et que le métabolite actif était chimiquement et biologiquement instable. Ce n'est qu'en 2000 que le métabolite actif a été découvert et sa cible plaquettaire a été découverte un an plus tard, le récepteur P2Y 12 de l'ADP.
Bien que le clopidogrel ait un meilleur rapport activité/toxicité que la ticlopidine, son activité posait encore des problèmes car 30 % des patients présentaient une résistance au clopidogrel. Le principal facteur de résistance au clopidogrel est le polymorphisme du CYP2C19 , qui survient chez 30 à 55 % des patients. Cela a conduit à la perte des fonctions de l'enzyme qui a conduit à une mauvaise conversion du clopidogrel en son métabolite actif. Le métabolite lui-même est très instable et ne peut donc pas être stocké dans une chimiothèque . Cela a conduit au développement d'un composé qui dépend moins du métabolisme médié par le CYP, le prasugrel.
Prasugrel
Prasugrel, la thiénopyridine de troisième génération a été mis sur le marché en 2009 par les sociétés pharmaceutiques Daiichi Sankyo/Eli Lilly. Le prasugrel, comme ses précurseurs est une pro-drogue mais son métabolisme commence dans les intestins où il est métabolisé par l'estérase en une thiolactone, cet intermédiaire inactif subit ensuite une ouverture de cycle médiée par le CYP, principalement par le CYP3A4 et le CYP2B6 en métabolite actif. Ainsi, le prasugrel n'est pas soumis à une résistance au clopidogrel.
Inhibiteurs des récepteurs ADP de nouvelle génération
Ticagrélor
L'accent a été mis sur la recherche d'un inhibiteur de P2Y 12 qui n'est pas un métabolite et avec un début d'action plus rapide. Il était connu que l'ATP antagonise de manière compétitive l'agrégation plaquettaire induite par l'ADP, mais l'ATP est très instable. L'attention s'est portée sur la création d'analogues de l'ATP avec une puissance et une stabilité plus élevées. Ces analogues avaient une demi-vie très courte en raison de la rétention des groupes triphosphate et devaient donc être administrés par voie IV. La modification de ces analogues ont conduit à la découverte de ticagrelor, sélectif et stable P2Y non-phosphate 12 antagoniste du récepteur. Le ticagrélor appartient à la classe des cyclopentyl-triazolopyrimidine (CPTP). Le ticagrelor est arrivé sur le marché en 2010 en Europe et en 2011 aux États-Unis.
Cangrelor
Cangrelor, un autre analogue de l'ATP comme le ticagrelor, est stable à la dégradation enzymatique. Il a un début d'action rapide car il n'est pas décomposé en un métabolite actif comme les thiénopyridines. AstraZeneca a obtenu une licence exclusive pour le cangrelor en décembre 2003. En 2009, le sponsor de l'essai de phase 3 s'est retiré, où le cangrelor était testé contre un placebo. Le développement de Cangrelor a été interrompu pendant un certain temps lorsque le promoteur s'est retiré après que le comité d'examen des analyses intermédiaires (CIRC) a décidé que l'essai ne montrerait pas l'efficacité clinique « convaincante » qui est nécessaire pour l'approbation réglementaire. Cependant, l'essai Champion phoenix (sponsorisé par la société biopharmaceutique The Medicines Company), un essai contrôlé par placebo à double insu et à double insu où 11 145 patients subissant une ICP plutôt urgente ou élective ont été randomisés pour recevoir du cangrelor ou du clopidogrel avant que l'ICP ne montre que cangrelor a considérablement réduit le taux d'événements ischémiques au cours de l'ICP. Le cangrelor a plus diminué le développement de la thrombose du stent que le clopidogrel. Ces résultats ont été publiés en 2013. Cangrelor a obtenu l' approbation de la FDA en juin 2015 en tant que médicament antiplaquettaire pour application intraveineuse.
Mécanisme d'action
La cible moléculaire du métabolite actif des inhibiteurs des récepteurs ADP est le récepteur P2Y 12 . Le récepteur P2Y 12 est un récepteur couplé au G et est activé par l' adénosine diphosphate . L'ADP se lie au récepteur P2Y 12 qui conduit à l'inhibition de l' adényl cyclase et diminue ainsi les niveaux intracellulaires d'AMPc. Cette réduction de l'AMPc réduit la phosphorylation de la phosphoprotéine stimulée par un vasodilatateur qui conduit à l'activation des récepteurs de la glycoprotéine IIb/IIIa . L'activation des récepteurs de la glycoprotéine IIb/IIIa augmente la production de thromboxane et prolonge l'agrégation plaquettaire. La ticlopidine, le clopidogrel et le prasugrel sont des promédicaments de la thiénopyridine qui sont des inhibiteurs plaquettaires irréversibles du récepteur P2Y 12 . Le cangrelor et le ticagrelor sont des inhibiteurs de P2Y 12 à action directe qui modifient la conformation du récepteur P2Y 12 et, par conséquent, entraînent une inhibition plaquettaire réversible du récepteur. Les thiénopyridines sont métabolisées dans le foie et l'intestin en métabolites actifs.
Métabolisme
La ticlopidine est une prodrogue et est métabolisée par au moins cinq voies principales. Il y a un métabolite actif qui a été identifié et qui a une activité antiplaquettaire. Ce métabolite actif est formé par une voie dépendante du CYP. Le CYP2C19 et le CYP2B6 sont des enzymes suggérées pour contribuer à la transformation métabolique de la ticlopidine en l' intermédiaire thiolactone , la 2-oxo-ticlopidine dans le foie. L'intermédiaire thiolactone est ensuite converti en métabolite actif de la ticlopidine via l'oxydation du CYP où l' activation de l' oxydation se produit. Cependant, les enzymes CYP impliquées dans cette voie sont inconnues. Dans la formation du métabolite actif, des métabolites supplémentaires ont été identifiés et il s'agit des métabolites du dihydrothiénopyridinium (M5) et du thienodihydropyridinium (M6). Ces métabolites peuvent être responsables des effets secondaires toxiques de la ticlopidine.
Le clopidogrel est un promédicament métabolisé par deux voies. Dans l'une des voies, la majeure partie de la dose de clopidogrel (85 %) est hydrolysée par des estérases en un dérivé d' acide carboxylique inactif et rapidement éliminée par glucoridination suivie d' une excrétion rénale . L'autre voie du clopidogrel nécessite une activation métabolique hépatique CYP450 en deux étapes pour produire le métabolite actif qui inhibe le récepteur P2Y 12 . Les CYP1A2, CYP3A4, CYP3A5 et CYP2C19 sont considérés comme les principales enzymes impliquées dans le métabolisme du clopidogrel. Le clopidogrel est d'abord métabolisé en 2-oxo-clopidogrel, qui à son tour est hydrolysé en métabolisme actif qui est un thiol . Le thiol forme un pont disulfure avec une cystéine dans le récepteur P2Y 12 et se lie ainsi de manière irréversible au récepteur P2Y 12 . Il est suggéré que le clopidogrel se lie de manière covalente à CYS17 ou CYS270 du récepteur P2Y 12 et bloque donc la liaison de l'agoniste. Certains utilisateurs de clopidogrel ont une activité défectueuse du CYP2C19 et, par conséquent, un métabolisme du CYP2C19 médiocre, ce qui entraîne un risque de diminution de l'activité du clopidogrel. En effet, le promédicament n'est pas métabolisé en médicament actif. Les médicaments qui sont des inhibiteurs du CYP2C19 peuvent interagir avec le clopidogrel et réduire l'activité du clopidogrel. Tous les inhibiteurs de la pompe à protons, à l'exception du rabéprazole et du pantoprazole, sont métabolisés par l'enzyme hépatique CYP450 et peuvent donc interagir avec le métabolisme du clopidogrel. L'oméprazole est considéré comme ayant un potentiel plus élevé d'interaction médicamenteuse que les autres inhibiteurs de la pompe à protéines car il s'agit d'un inhibiteur du CYP2C19.
Le prasugrel est une thiénopyridine de troisième génération et un promédicament. Contrairement à la ticlopidine et au clopidogrel, l'activation du prasugel implique l'hydrolyse en une thiolactone intermédiaire , qui est ensuite convertie en le métabolite actif en une seule étape dépendante du CYP. Le métabolite actif, qui est le R-138727 (thiol intermédiaire), se lie de manière irréversible au récepteur P2Y 12 ou est méthylé métaboliquement en un métabolite inactif. Le R-138727 est métaboliquement inactivé par S-méthylation. Le prasugrel n'est pas métabolisé par le CYP2C19 comme le clopidogrel et les variantes génétiques du CYP n'ont pas d'influence significative sur les métabolites actifs du prasugrel. Le prasugrel a un début d'action plus rapide et un blocage des récepteurs plus important avec le métabolite actif que le clopidogrel.
Le ticagrélor a été le premier inhibiteur réversible du récepteur P2Y 12 , actif après administration orale. Le ticagrélor est actif par voie orale sans qu'aucune activation métabolique ne soit nécessaire. Il est rapidement absorbé et subit une dégradation enzymatique en au moins un métabolite actif qui est presque aussi puissant que son composé parent. Le ticagrelor a amélioré les profils pharmacocinétique et pharmacodynamique par rapport aux médicaments actuellement disponibles pour le traitement du SCA. De plus, les génotypes du CYP2C19 connus pour influencer l'effet du clopidogrel n'ont pas influencé l'effet du ticagrelor.
Cangrelor est le premier inhibiteur réversible de la P2Y 12 qui peut être administré par voie intraveineuse et a un début et un décalage très rapides, ce qui peut présenter des avantages par rapport aux médicaments actuels et permettre au cangrelor de surmonter les limitations de l' inhibiteur oral de la P2Y 12 . Cela en fait une option intéressante pour le traitement antiplaquettaire, en particulier pour les patients incapables de prendre des médicaments par voie orale (par exemple, les patients inconscients, vomissant ou sous sédation). Comme le ticagrelor, il ne nécessite pas de conversion métabolique pour être actif et peut donc inhiber directement le récepteur P2Y 12 .
Conception de médicaments
Relation structure-activité (SAR)
Prasugrel a été développé avec le métabolisme à l'esprit. Cela a été fait en remplaçant le groupe ester par une cétone métaboliquement stable (groupe R1). De plus, l'ajout d'un groupe ester en position 2 du thiophène (groupe R2) a déplacé la première étape d'activation du CYP2C19 vers les estérases et le prasugrel n'est donc pas métabolisé par le CYP2C19 comme le clopidogrel.
| Composé | R1 | R2 | R3 |
| Clopidogrel | C | Cl | |
| Prasugrel | F |
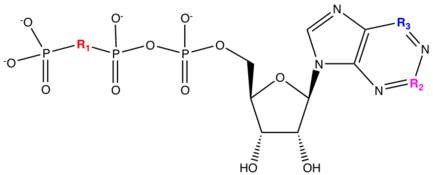
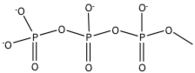
Le cangrelor et le ticagrelor sont de nouvelles classes de récepteurs P2Y 12 réversibles qui ont été développés pour cibler les problèmes de sécurité (hémorragie) et de non-répondeurs que présentent les thiénopyridines. Il a été démontré que des ligands naturels comme l' adénosine triphosphate ( ATP ) inhibent l'agrégation plaquettaire et ont été identifiés comme un faible antagoniste . Le cangrelor et le ticagrelor sont des analogues nucléotidiques dont la structure chimique ressemble à l'adénosine triphosphate (ATP). L'ATP peut être métabolisé dans les tissus cardiovasculaires en ADP, AMP ou adénosine pro-agrégatifs. Le remplacement de l'anhydride oxygène entre le phosphore (Pβ) et le phosphore (Pγ) par du di-Chloro ou du di-Fluoro-méthylène conduit à un composé équipotent à l'ATP et ayant un pKa similaire . En raison de ce remplacement, le métabolisme de l'ATP en pro-agrégation peut être évité. En ajoutant du S-propyle à la longueur de la chaîne, cela a eu un impact majeur sur l'activité. L'ajout d'une alkylamine monosubstituée à la position C4 de l'adénosine a conduit à une augmentation de dix fois de l'activité et également à la longueur du substituant alkylamine en corrélation avec le décalage de l'effet. L'ajout d'un groupe méthylsulfanyléthylamino à la position C4 et trifluoropropylsulfanyl à la longueur de la chaîne conduit à la formation du médicament cangrelor qui a une activité accrue. Cangrelor a une récupération moyenne de 78 % de l'agrégation plaquettaire induite par l'ADP chez le rat après 20 minutes par rapport au composé 1C qui a une récupération inférieure à 10 %.
| Composé | pIC50 | R1 | R2 | R3 |
|---|---|---|---|---|
| ATP | 3.6 | O | C | C-NH2 |
| 1A | 3.5 | C | C-NH2 | |
| 1B | 8.6 | C-NH2 | ||
| 1C | 9.1 | |||
| Cangrelor | 9.4 |
Pour répondre au besoin du médicament oral réversible ticagrelor, la chaîne phosphate du cangrelor a été remplacée par un acide aspartique , ce qui a entraîné une réduction de 300 fois de la puissance. La puissance du ticagrelor a été ramenée au même niveau que celle du cangrelor en remplaçant la purine par de la triazolopyrimidine. L' unité sucre ribose a également été remplacée par un groupe cyclopentyle pour éviter une éventuelle instabilité de la liaison glycosidique . Le groupe sur le côté gauche de la structure a été remplacé par le sidecain R1. Les chaînes latérales neutres R1=CONH 2 et R1=CH 2 OH ont été acceptées avec une légère perte d'affinité et le métabolisme est passé du métabolisme biliaire au métabolisme hépatique . Pour cette raison, des tests microsomaux hépatiques in vitro pourraient être utilisés, ce qui simplifiait l'optimisation des propriétés pharmacocinétiques. L'addition du substituant phényl cyclopropylamine en position 5 a donné des affinités élevées. De là, le premier composé s'est avéré avoir une biodisponibilité orale mesurable chez le rat (R1 = CH 2 OH). La variation de R2 a eu un impact mineur sur l'affinité qui a permis l'introduction de groupes pour améliorer les propriétés pharmacocinétiques, par exemple R1=OCH 2 CH 2 OH. L'introduction de fluors au niveau du cycle phényle et à l'extrémité de la chaîne alkyle thioéther conduit à une stabilité métabolique encore améliorée. En remplaçant les fluors de la chaîne alkyle thioéther en S-propyle, cela conduit à la formulation de ticagrelor.
| Composé | pIC50 | R1 | R2 | R3 | R4 | R5 |
|---|---|---|---|---|---|---|
| ATP | 3.6 | C | O | C-NH2 | C | |
| 2A | 7.0 | C | O | |||
| 2B | 9.3 | N | C | |||
| 2C | COOH=9,3 CONH 2 =7,7
CH 2 OH = 7,1 |
COOH, CONH 2 ou
CH 2 OH |
N | C | ||
| 2D | COOH=9.6
CONH 2 =8,8 CH 2 OH = 8,3 H=8,6 OCH 2 CH 2 OH = 8,5 |
COOH, CONH 2, CH 2 OH, H ou
OCH 2 CH 2 OH |
N | C | ||
| 2E | 9.2 | OCH 2 CH 2 OH | N | C | ||
| Ticagrélor | 8.3 | OCH 2 CH 2 OH | N | C |
Utilisation clinique
L'activation des plaquettes et l'agrégation subséquente des plaquettes jouent un rôle crucial dans le maintien d'une hémostase normale . Une perturbation de ce système peut entraîner des maladies cérébrovasculaires , cardiovasculaires et vasculaires périphériques où elle peut entraîner un accident vasculaire cérébral, un angor instable et un infarctus du myocarde. Lorsqu'un vaisseau est endommagé, l'ADP est libéré des cellules endommagées et des plaquettes activées, induisant une agrégation plaquettaire supplémentaire.
Ticlopidine
La ticlopidine, un bloqueur des récepteurs de la thiénopyridine P2Y 12 de première génération, a été retirée de l'utilisation clinique à la suite d'une incidence élevée d'effets secondaires tels que le purpura thrombocytopénique thrombotique , l'anémie aplasique et la neutropénie . L'utilisation clinique du médicament a été rapidement éclipsée par le clopidogrel, car ce dernier avait moins d' effets secondaires gastro - intestinaux et une meilleure sécurité hématologique .
Clopidogrel
Le clopidogrel, un bloqueur des récepteurs de la thiénopyridine P2Y 12 de deuxième génération, est un agent antiplaquettaire efficace utile pour le traitement de la libération ischémique cérébrovasculaire, cardiaque et artérielle périphérique. Comme d'autres médicaments à base de thiénopyridine, le médicament était souvent associé à de l'aspirine en usage clinique. La posologie cliniquement approuvée de clopidogrel est une dose de charge de 300 mg PO et une dose d'entretien PO de 75 mg par jour .
Pendant de nombreuses années, le double traitement avec l' aspirine et le clopidogrel, un inhibiteur de la cyclooxygénase-1 (COX-1) était une pratique courante et a servi d'agents antiplaquettaires principaux pour la prévention des événements thrombotiques car ils ont la capacité de manipuler puissamment la biologie plaquettaire, qui joue un rôle central. participe à la thrombose. Cependant, l'utilisation de ces agents est toujours soumise à un certain nombre de limitations importantes telles que l'exposition à un risque accru de saignement , ce qui rend la durée et la posologie du clopidogrel de la plus haute importance. De plus, la réponse au clopidogrel n'est pas uniforme et une faible réponse peut entraîner des événements cardiovasculaires indésirables majeurs .
Nouvelles générations
La nouvelle génération de bloqueurs P2Y 12 visait à résoudre ces problèmes, promettant une amélioration des résultats pour les patients. Ces bloqueurs P2Y 12 récemment développés (ticagrelor, cangrelor, prasugrel et élinogrel) fournissent une inhibition plus cohérente et plus forte des plaquettes en s'opposant plus efficacement au récepteur P2Y 12 . Cependant, cette inhibition plaquettaire plus puissante se fait au prix d'un risque hémorragique plus élevé.
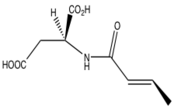
Le prasugrel, une thiénopyridine de troisième génération, est métabolisé plus efficacement que le clopidogrel et la ticlopidine dans l'organisme et, par conséquent, il empêche davantage l'activation plaquettaire. Des études ont montré que le prasugrel réduisait le risque de thrombose du stent et d'infarctus du myocarde à un niveau beaucoup plus élevé que le clopidogrel. La dose de prasugrel cliniquement approuvée est une dose de charge de 60 mg PO et une dose d'entretien de 10 mg par jour PO.
Le ticagrélor est un inhibiteur beaucoup plus puissant de l'agrégation plaquettaire que le clopidogrel, cependant, il est associé à une augmentation des épisodes de dyspnée chez les patients. Ces épisodes peuvent varier de gravité légère à modérée. La posologie clinique approuvée du ticagrelor est une dose de charge de 180 mg PO et une dose d'entretien de 90 mg par jour.
Le seul médicament parental ciblant le récepteur P2Y 12 en usage clinique est le cangrelor.
Interactions
L'enzyme CYP2C19 métabolise les inhibiteurs de la pompe à protons (IPP) ainsi que le clopidogrel. Divers rapports ont indiqué qu'il existe une interaction médicamenteuse négative entre le clopidogrel et l'oméprazole . Certaines études ont montré que l'activité du clopidogrel sur les plaquettes était entravée de manière significative par les patients recevant un traitement par l' oméprazole , un inhibiteur de la pompe à protons (IPP). Une autre étude a également montré que le lansoprazole avait des effets inhibiteurs sur l'activité du clopidogrel. Cependant, d'autres études ont montré que la prise de pantoprazole ou d' ésoméprazole de l'IPP n'était pas associée à une altération de la réponse au clopidogrel.
En 2009, la Food and Drug Administration ( FDA ) des États-Unis et l' Agence européenne des médicaments (EMA) ont découragé l'association du clopidogrel et des IPP, en particulier l'oméprazole, en raison des observations faites à l'époque par les études de cohorte initiales. Cependant, des études de cohorte rétrospectives plus récentes n'ont pas montré d'événements cardiovasculaires indésirables causés par des interactions clopidogrel-IPP. Par conséquent, il n'existe aucune preuve définitive de l'effet des interactions médicamenteuses sur la mortalité.
Pour les patients présentant un risque élevé d'hémorragie gastro-intestinale, le risque l'emporte sur les effets cardiovasculaires indésirables possibles. Il doit donc être recommandé à ces patients d'associer le clopidogrel à des IPP moins inhibiteurs du CYP2C19, tels que le pantoprazole.
Résistance au clopidogrel
La résistance du clopidogrel est apparue au fil des années et est devenue une préoccupation majeure pour le traitement des patients atteints de SCA ou subissant une ICP. On rapporte que la résistance au clopidogrel varie de 4 à 44 % entre les différentes populations et groupes ethniques . Les patients exposés à une résistance au clopidogrel présentent une activité d'inhibition plaquettaire plus faible en raison de la diminution des taux du métabolite actif du clopidogrel. Il en résulte une série d'incidents cliniques, par exemple des complications ischémiques et thromboemboliques. Ces patients sont reconnus comme mauvais ou non répondeurs.
Le clopidogrel est un promédicament qui nécessite une métabolisation en deux étapes à l'aide d'enzymes pour devenir un métabolite actif. L'une des enzymes cruciales dans le métabolisme du clopidogrel est le CYP2C19, qui est impliqué dans les deux étapes de la biotransformation. Un polymorphisme de l'enzyme CYP2C19 affecte la réponse au clopidogrel, diminuant ainsi l'activité enzymatique et donc réduisant le métabolite actif du clopidogrel.
Le problème majeur de la résistance au clopidogrel est l'interaction avec d'autres médicaments, en particulier l'oméprazole, un inhibiteur de la pompe à protons. L'oméprazole et le clopidogrel sont métabolisés par la même voie métabolique du CYP. Par conséquent, il a été suggéré que la faible réactivité du clopidogrel, avec l'utilisation concomitante d'oméprazole, est causée par la compétition de l'enzyme CYP2C19 entre ces deux médicaments.
Les approches cliniques sur la façon de surmonter la résistance au clopidogrel comprennent des doses plus élevées de clopidogrel, l'utilisation concomitante avec l' inhibiteur de la phosphodiestérase cilostazol ou le passage à un nouvel agent antiplaquettaire tel que le prasugrel et le ticagrelor. Pourtant, la principale préoccupation avec ces méthodes ci-dessus est un risque accru de saignement. Par conséquent, le besoin d'un nouvel agent antiplaquettaire avec un début d'action rapide, moins de variabilité de la réponse entre les individus et un profil d'innocuité amélioré est essentiel.
Perspectives d'avenir
Le développement d'inhibiteurs de l'ADP progresse constamment et la recherche d' antagonistes P2Y 12 encore meilleurs est toujours en cours. La pierre angulaire de la prévention secondaire des événements athérothrombotiques chez les patients atteints de SCA ou subissant une ICP est une bithérapie antiplaquettaire avec de l'aspirine et du clopidogrel. Néanmoins, des événements d'athérothrombose se produisent encore. Les limites des médicaments antiplaquettaires actuels comprennent le risque de saignement et la variabilité interindividuelle de la réponse inhibitrice des plaquettes.
L'objectif est de déterminer la fenêtre thérapeutique optimale pour maximiser les avantages thérapeutiques tout en réduisant les problèmes de sécurité comme les saignements. Par conséquent, le principal objectif non atteint des inhibiteurs de l'ADP est de développer un agent antiplaquettaire réversible puissant avec un début d'action rapide, des niveaux élevés d'activité antiplaquettaire tout en réduisant le risque de saignement. Cet objectif ambitieux, associé à un profil oral à prise unique quotidienne et à une sélectivité de cible optimisée, constituerait probablement une percée importante dans ce domaine.
Vicagrel est le dernier développement, en date de septembre 2017, dans ce secteur. Un nouvel analogue acétate du clopidogrel qui devrait améliorer l'efficacité antiplaquettaire ainsi qu'une diminution du risque de saignement. Des études pharmacocinétiques préliminaires du vicagrel ont montré une biodisponibilité plus élevée que celle du clopidogrel, indiquant une dose thérapeutique efficace beaucoup plus faible pour le vicagrel. Les avantages du vicagrel par rapport au clopidogrel sont considérés comme l'absence de résistance aux médicaments pour les métaboliseurs lents du CYP2C19, une diminution de la toxicité liée à la dose en raison d'une dose efficace plus faible et d'un délai d'action plus rapide .