Hespéridine - Hesperidin
|
|
| Noms | |
|---|---|
|
Nom IUPAC
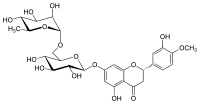
(2 S )-3′,5-Dihydroxy-4′-méthoxy-7-[α- L -rhamnopyranosyl-(1→6)-β- D -glucopyranosyloxy]flavan-4-one
|
|
|
Nom IUPAC préféré
(2 2 S ,4 2 S ,4 3 R ,4 4 S ,4 5 S ,4 6 R ,7 2 R ,7 3 R ,7 4 R ,7 5 R ,7 6 S )-1 3 ,2 5 ,4 3 ,4 4 ,4 5 ,7 3 ,7 4 ,7 5 -Octahydroxy-1 4 -méthoxy-7 6 -méthyl-2 2 ,2 3 -dihydro-2 4 H -3,6-dioxa- 2(2,7)-[1]benzopyrana-4(2,6),7(2)-bis(oxana)-1(1)-benzenaheptaphan-2 4 -one |
|
| Autres noms
Hespérétine 7-rutinoside
|
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Carte d'information de l'ECHA |
100.007.536 |
|
CID PubChem
|
|
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 28 H 34 O 15 | |
| Masse molaire | 610,565 g·mol -1 |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Références de l'infobox | |
L'hespéridine est un glycoside de flavanone présent dans les agrumes . Sa forme aglycone est appelée hespérétine . Son nom est dérivé du mot « hesperidium », pour les fruits produits par les agrumes.
L'hespéridine a été isolée pour la première fois en 1828 par le chimiste français Lebreton à partir de la couche interne blanche d'écorces d'agrumes (mésocarpe, albédo).
On pense que l'hespéridine joue un rôle dans la défense des plantes .
Sources
Rutacées
- 700 - 2 500 ppm dans les fruits de Citrus aurantium L. - Orange amère, Petitgrain
- dans du jus d'orange ( Citrus sinensis )
- chez Zanthoxylum gilletii
- au citron
- à la chaux
- dans les feuilles d' Agathosma serratifolia
Lamiacées
La menthe poivrée contient de l'hespéridine.
Contenu dans les aliments
Teneur approximative en hespéridine pour 100 ml
- 481 mg de menthe poivrée, séchée
- 44 mg d' orange sanguine , pur jus
- 26 mg d' orange , pur jus
- 18 mg de citron , pur jus
- 14 mg citron vert , pur jus
- 1 mg de pamplemousse , pur jus
Métabolisme
L'hespéridine 6-O-alpha-L-rhamnosyl-bêta-D-glucosidase , une enzyme qui utilise l'hespéridine et H 2 O pour produire de l' hespérétine et du rutinose , se trouve dans l' espèce Ascomycetes .
Recherche
En tant que flavanone présente dans les écorces d'agrumes (comme les oranges ou les citrons), l'hespéridine fait l'objet de recherches préliminaires pour ses éventuelles propriétés biologiques in vivo . Une revue n'a trouvé aucune preuve que l'hespéridine affectait les taux de lipides sanguins ou l' hypertension . Une autre revue a révélé que l'hespéridine pouvait améliorer la fonction endothéliale chez l'homme, mais les résultats globaux n'étaient pas concluants.
Biosynthèse
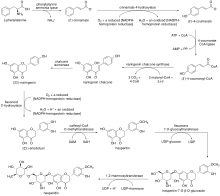
La biosynthèse de l'hespéridine provient de la voie des phénylpropanoïdes , dans laquelle l'acide aminé naturel L- phénylalanine subit une désamination par la phénylalanine ammonia lyase pour donner le ( E )-cinnamate . Le monocarboxylate résultant subit une oxydation par la cinnamate 4-hydroxylase pour donner le ( E )-4-coumarate, qui est transformé en ( E )-4-coumaroyl-CoA par la 4-coumarate-CoA ligase . ( E )-4-coumaroyl-CoA est ensuite soumis à la polykétide synthase de type III naringénine chalcone synthase , subissant des réactions de condensation successives et finalement une condensation de Claisen à fermeture de cycle pour donner la naringénine chalcone . La chalcone correspondante subit une isomérisation par la chalcone isomérase pour donner la (2 S )-naringénine , qui est oxydée en (2 S )-ériodictyol par la flavonoïde 3'-hydroxylase . Après O méthylation par caféoyl-CoA O -méthyltransférase , les hespéritine produit subit une glycosylation par flavanone 7- O -glucosyltransferase pour donner hespéritine-7- O -β-D-glucoside. Enfin, une fraction rhamnosyle est introduite dans le produit monoglycosylé par la 1,2-rhamnosyltransférase, formant l'hespéridine.
Voir également
- Diosmine
- Liste des composés phytochimiques dans les aliments
- Liste des codes MeSH (D03)
- Liste des additifs alimentaires
Les références
Liens externes
-
 Médias liés à l' hespéridine sur Wikimedia Commons
Médias liés à l' hespéridine sur Wikimedia Commons