Hexose - Hexose
En chimie , un hexose est un monosaccharide (sucre simple) à six atomes de carbone. La formule chimique de tous les hexoses est C 6 H 12 O 6 et leur poids moléculaire est de 180,156 g/mol.
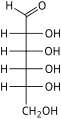
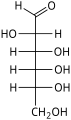
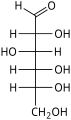
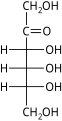
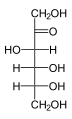
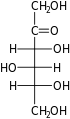
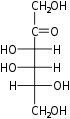
Les hexoses existent sous deux formes, à chaîne ouverte ou cyclique, qui se transforment facilement l'une dans l'autre dans des solutions aqueuses. La forme à chaîne ouverte d'un hexose, qui est généralement favorisée dans les solutions, a la structure générale H–(CHOH) n −1 –C(=O)–(CHOH) 4− n –H, où n vaut 1, 2 , ou 3. À savoir, cinq des carbones ont un groupe fonctionnel hydroxyle (-OH) chacun, relié par une simple liaison , et un a un groupe oxo (=O), formant un groupe carbonyle (C=O). Les liaisons restantes des atomes de carbone sont satisfaites par sept atomes d' hydrogène . Les carbones sont communément numérotés de 1 à 6 en commençant à l'extrémité la plus proche du carbonyle.
Les hexoses sont extrêmement importants en biochimie , à la fois en tant que molécules isolées (telles que le glucose et le fructose ) et en tant que blocs de construction d'autres composés tels que l' amidon , la cellulose et les glycosides . Les hexoses peuvent former du dihexose (comme le saccharose ) par une réaction de condensation qui crée une liaison 1,6- glycosidique .
Lorsque le carbonyle est en position 1, formant un groupe formyle (–CH=O), le sucre est appelé aldohexose , cas particulier de l' aldose . Sinon, si la position carbonyle est 2 ou 3, le sucre est un dérivé d'une cétone , et s'appelle un cétohexose , un cas particulier du cétose ; spécifiquement, un n- cétohexose . Cependant, les 3-cétohexoses n'ont pas été observés dans la nature, et sont difficiles à synthétiser ; ainsi, le terme "cétohexose" signifie généralement 2-cétohexose.
Sous la forme linéaire, il existe 16 aldohexoses et huit 2-cétohexoses, des stéréoisomères qui diffèrent par la position spatiale des groupes hydroxyle. Ces espèces se présentent par paires d' isomères optiques . Chaque paire a un nom conventionnel (comme "glucose" ou "fructose"), et les deux membres sont étiquetés " D - " ou " L - ", selon que l'hydroxyle en position 5, dans la projection de Fischer de la molécule, se trouve respectivement à droite ou à gauche de l'axe. Ces marqueurs sont indépendants de l' activité optique des isomères. En général, un seul des deux énantiomères est présent naturellement (par exemple, le D- glucose) et peut être métabolisé par les animaux ou fermenté par les levures .
Le terme "hexose" est parfois supposé inclure les désoxyhexoses , tels que le fucose et le rhamnose : composés de formule générale C
6H
12O
6- y qui peut être décrit comme dérivé d'hexoses par remplacement d'un ou plusieurs groupes hydroxyle par des atomes d'hydrogène.
Classification
Aldohexoses
Les aldohexoses sont une sous-classe des hexoses qui, sous forme linéaire, ont le carbonyle au carbone 1, formant un dérivé aldéhydique de structure H–C(=O)–(CHOH) 5 –H. L'exemple le plus important est le glucose .
Sous forme linéaire, un aldohexose a quatre centres chiraux , qui donnent 16 stéréoisomères d' aldohexose possibles (2 4 ), comprenant 8 paires d' énantiomères . Les formes linéaires des huit D- aldohexoses, dans la projection de Fischer , sont
Parmi ces isomères D , tous sauf le D- altrose sont présents dans les organismes vivants, mais seuls trois sont courants : le D- glucose, le D- galactose et le D- mannose. Les isomères L sont généralement absents dans les organismes vivants ; cependant, le L- altrose a été isolé à partir de souches de la bactérie Butyrivibrio fibrisolvens .
Le chimiste Emil Fischer aurait conçu le dispositif mnémotechnique suivant pour se souvenir de l'ordre donné ci-dessus, qui correspond aux configurations concernant les centres chiraux lorsqu'ils sont ordonnés sous forme de chaînes binaires de 3 bits :
- Tous alt ruists Gl Adly ma ke gu m i n gal lon ta NKS.
se référant à tous les OSE, ALTR OSE, gl ucose, ma nnose, gu lose, i dose, gal actose, ta perdre.
Lorsqu'elles sont dessinées dans cet ordre, les projections de Fischer des D- aldohexoses peuvent être identifiées avec les nombres binaires à 3 chiffres de 0 à 7, à savoir 000, 001, 010, 011, 100, 101, 110, 111. Les trois bits , de gauche à droite, indiquez la position des hydroxyles sur les carbones 4, 3 et 2, respectivement : à droite si la valeur du bit est 0, et à gauche si la valeur est 1.
Les diagrammes de Fischer des huit L- aldohexoses sont les images miroir des D- isomères correspondants ; avec tous les hydroxyles inversés, y compris celui sur le carbone 5.
Cétohexoses
Un cétohexose est un hexose contenant des cétones. Biologiquement, l'exemple le plus important est le fructose .
Sous forme linéaire, les 2-cétohexoses ont trois centres chiraux et donc huit stéréoisomères possibles (2 3 ), comprenant quatre paires d'énantiomères. Les quatre isomères D sont :
Les formes L correspondantes ont les hydroxyles sur les carbones 3, 4 et 5 inversés. Vous trouverez ci-dessous une représentation des huit isomères dans un style alternatif :
3-cétohexoses
En théorie, les cétohexoses comprennent également les 3-cétohexoses, qui ont le carbonyle en position 3 ; à savoir H–(CHOH) 2 –C(=O)–(CHOH) 3 –H. Cependant, ces composés ne sont pas connus pour se produire dans la nature et sont difficiles à synthétiser.
En 1897, un produit non fermentescible obtenu par traitement du fructose avec des bases , en particulier l' hydroxyde de plomb (II) , a reçu le nom de glutose , un portemanteau de glucose et de fructose , et a été revendiqué comme un 3-cétohexose. Cependant, des études ultérieures ont montré que la substance était un mélange de divers autres composés.
La synthèse et l'isolement sans équivoque d'un 3-cétohexose, le xylo -3-hexulose , par une voie assez complexe, a été rapporté pour la première fois en 1961 par G. Yuen et J. Sugihara .
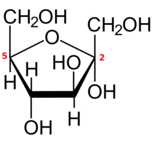
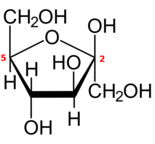
Formes cycliques
Comme la plupart des monosaccharides à cinq carbones ou plus, chaque aldohexose ou 2-cétohexose existe également sous une ou plusieurs formes cycliques (à chaîne fermée), dérivées de la forme à chaîne ouverte par un réarrangement interne entre le groupe carbonyle et l'un des groupes hydroxyle .
La réaction transforme le groupe =O en un hydroxyle et l'hydroxyle en un pont éther (–O–) entre les deux atomes de carbone, créant ainsi un cycle avec un atome d' oxygène et quatre ou cinq carbones.
Si le cycle a cinq atomes de carbone (six atomes au total), la forme fermée s'appelle un pyranose , après l' éther cyclique tétrahydropyrane , qui a le même cycle. Si le cycle comporte quatre atomes de carbone (cinq au total), la forme est appelée furanose d' après le composé tétrahydrofurane . La numérotation conventionnelle des carbones dans la forme fermée est la même que dans la forme à chaîne ouverte.
Si le sucre est un aldohexose, avec le carbonyle en position 1, la réaction peut impliquer l'hydroxyle sur le carbone 4 ou le carbone 5, créant un hémiacétal avec un cycle à cinq ou six membres, respectivement. Si le sucre est un 2-cétohexose, il ne peut impliquer que l'hydroxyle dans le carbone 5 et créera un hémimétal avec un cycle à cinq membres.
La fermeture transforme le carbone carboxyle en un centre chiral , qui peut avoir l'une des deux configurations, en fonction de la position du nouvel hydroxyle. Par conséquent, chaque hexose sous forme linéaire peut produire deux formes fermées distinctes, identifiées par les préfixes "α" et "β".
On sait depuis 1926 que les hexoses à l'état solide cristallin prennent la forme cyclique. Les formes "α" et "β", qui ne sont pas des énantiomères, cristalliseront habituellement séparément en tant qu'espèces distinctes. Par exemple, le D- glucose forme un cristal qui a une rotation spécifique de +112° et un point de fusion de 146 °C, ainsi qu'un cristal qui a une rotation spécifique de +19° et un point de fusion de 150 °C.
La forme linéaire ne cristallise pas et n'existe qu'en petites quantités dans les solutions aqueuses, où elle est en équilibre avec les formes fermées. Néanmoins, il joue un rôle essentiel en tant qu'étape intermédiaire entre ces formes fermées.
En particulier, les formes "α" et "β" peuvent se convertir l'une dans l'autre en revenant à la forme en chaîne ouverte puis en se fermant dans la configuration opposée. Ce processus est appelé mutarotation .
Propriétés chimiques
Bien que tous les hexoses aient des structures similaires et partagent certaines propriétés générales, chaque paire d'énantiomères a sa propre chimie. Le fructose est soluble dans l'eau, l'alcool et l'éther. Les deux énantiomères de chaque paire ont généralement des propriétés biologiques très différentes.
2-cétohexoses sont stables sur une large gamme de pH, et avec une p primaire K a de 10,28, sont uniquement déprotoner à un pH élevé, de sorte que sont un peu moins stables que les aldohexoses en solution.
Occurrence naturelle et utilisations
L'aldohexose le plus important en biochimie est le D - glucose , qui est le principal "carburant" du métabolisme de nombreux organismes vivants.
Les 2-cétohexoses psicose , fructose et tagatose se présentent naturellement sous forme d' isomères D , tandis que le sorbose se présente naturellement sous forme d' isomère L.
Le D- sorbose est couramment utilisé dans la synthèse commerciale de l'acide ascorbique. Le D- tagatose est un cétohexose naturel rare que l'on trouve en petites quantités dans les aliments. D - Le fructose est responsable du goût sucré de nombreux fruits, et est un élément constitutif du saccharose , le sucre commun.
Désoxyhexoses
Le terme "hexose" peut parfois être utilisé pour inclure les désoxyaldohexoses, qui ont un ou plusieurs hydroxyles (-OH) remplacés par des atomes d' hydrogène (-H). Il est nommé comme l'hexose parent, avec le préfixe " x -deoxy-", le x indiquant le carbone avec l'hydroxyle affecté. Quelques exemples d'intérêt biologique sont
- L -Fucose(6-désoxy- L- galactose)
- L -Rhamnose(6-désoxy- L- mannose)
- D -Quinovose(6-désoxy- D -glucose), présent dans lesulfolipide sulfoquinovosyl diacylglycérol(SQDG)
- L- Pneumose(6-désoxy- L- talose)
Voir également
Les références
Liens externes
-
 Médias liés aux aldohexoses sur Wikimedia Commons
Médias liés aux aldohexoses sur Wikimedia Commons -
 Médias liés aux cétohexoses sur Wikimedia Commons
Médias liés aux cétohexoses sur Wikimedia Commons