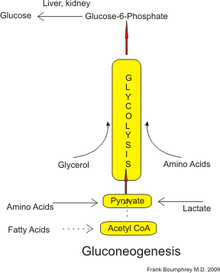
Gluconogenèse - Gluconeogenesis
La néoglucogenèse ( GNG ) est une voie métabolique qui entraîne la production de glucose à partir de certains substrats carbonés non glucidiques . C'est un processus omniprésent, présent chez les plantes, les animaux, les champignons, les bactéries et autres micro-organismes. Chez les vertébrés, la néoglucogenèse se produit principalement dans le foie et, dans une moindre mesure, dans le cortex des reins . C'est l'un des deux principaux mécanismes - l'autre étant la dégradation du glycogène ( glycogénolyse ) - utilisé par l'homme et de nombreux autres animaux pour maintenir les niveaux de sucre dans le sang , en évitant les faibles niveaux ( hypoglycémie ). Chez les ruminants , parce que les glucides alimentaires ont tendance à être métabolisés par les organismes du rumen , la néoglucogenèse se produit indépendamment du jeûne, des régimes pauvres en glucides, de l'exercice, etc. Chez de nombreux autres animaux, le processus se produit pendant les périodes de jeûne , de famine , de régimes pauvres en glucides ou exercice intense .
Chez l'homme, les substrats de la néoglucogenèse peuvent provenir de toute source non glucidique pouvant être convertie en pyruvate ou en intermédiaires de glycolyse (voir figure). Pour la dégradation des protéines , ces substrats comprennent des acides aminés glucogéniques (mais pas des acides aminés cétogènes ) ; de la dégradation des lipides (tels que les triglycérides ), ils comprennent le glycérol , les acides gras à chaîne impaire (bien que pas les acides gras à chaîne paire, voir ci-dessous); et d'autres parties du métabolisme, ils comprennent le lactate du cycle de Cori . Dans des conditions de jeûne prolongé, l'acétone dérivée des corps cétoniques peut également servir de substrat, fournissant une voie des acides gras au glucose. Bien que la plupart de la néoglucogenèse se produise dans le foie, la contribution relative de la néoglucogenèse par le rein est augmentée dans le diabète et le jeûne prolongé.
La voie de la néoglucogenèse est hautement endergonique jusqu'à ce qu'elle soit couplée à l'hydrolyse de l' ATP ou du GTP , rendant effectivement le processus exergonique . Par exemple, la voie menant du pyruvate au glucose-6-phosphate nécessite 4 molécules d'ATP et 2 molécules de GTP pour se dérouler spontanément. Ces ATP sont fournis par le catabolisme des acides gras via la bêta-oxydation .
Précurseurs

- Les acides aminés glucogéniques ont cette capacité
- Les acides aminés cétogènes ne le font pas. Ces produits peuvent encore être utilisés pour la cétogenèse ou la synthèse des lipides .
- Certains acides aminés sont catabolisés en produits glucogéniques et cétogènes.
Chez l'homme, les principaux précurseurs gluconéogènes sont le lactate , le glycérol (qui fait partie de la molécule de triglycéride ), l' alanine et la glutamine . Au total, ils représentent plus de 90 % de la néoglucogenèse globale. D'autres acides aminés glucogéniques et tous les intermédiaires du cycle de l'acide citrique (par conversion en oxaloacétate ) peuvent également fonctionner comme substrats pour la gluconéogenèse. Généralement, la consommation humaine de substrats gluconéogènes dans les aliments n'entraîne pas d'augmentation de la néoglucogenèse.
Chez les ruminants , le propionate est le principal substrat gluconéogène. Chez les non-ruminants, y compris les êtres humains, le propionate provient de la -oxydation d'acides gras à chaîne impaire et à chaîne ramifiée et est un substrat (relativement mineur) pour la gluconéogenèse.
Le lactate est ramené au foie où il est converti en pyruvate par le cycle de Cori en utilisant l'enzyme lactate déshydrogénase . Le pyruvate, le premier substrat désigné de la voie gluconéogénique, peut ensuite être utilisé pour générer du glucose. La transamination ou la désamination des acides aminés facilite l'entrée de leur squelette carboné dans le cycle directement (sous forme de pyruvate ou d'oxaloacétate), ou indirectement via le cycle de l'acide citrique. La contribution du lactate du cycle de Cori à la production globale de glucose augmente avec la durée du jeûne . Plus précisément, après 12, 20 et 40 heures de jeûne par des volontaires humains, la contribution du lactate du cycle de Cori à la néoglucogenèse était de 41 %, 71 % et 92 %, respectivement.
La question de savoir si les acides gras à chaîne paire peuvent être convertis en glucose chez les animaux est une question de longue date en biochimie. Les acides gras à chaîne impaire peuvent être oxydés pour donner de l' acétyl-CoA et du propionyl-CoA , ce dernier servant de précurseur au succinyl-CoA , qui peut être converti en pyruvate et entrer dans la gluconéogenèse. En revanche, les acides gras à chaîne paire sont oxydés pour ne donner que de l'acétyl-CoA, dont l'entrée dans la néoglucogenèse nécessite la présence d'un cycle de glyoxylate (également connu sous le nom de shunt de glyoxylate) pour produire des précurseurs d'acide dicarboxylique à quatre carbones. Le shunt du glyoxylate comprend deux enzymes, la malate synthase et l'isocitrate lyase, et est présent dans les champignons, les plantes et les bactéries. Malgré certains rapports d'activités enzymatiques de shunt du glyoxylate détectées dans les tissus animaux, les gènes codant pour les deux fonctions enzymatiques n'ont été trouvés que chez les nématodes , dans lesquels ils existent en tant qu'enzyme bifonctionnelle unique . Des gènes codant pour la malate synthase seule (mais pas pour l'isocitrate lyase) ont été identifiés chez d'autres animaux, notamment des arthropodes , des échinodermes et même certains vertébrés . Les mammifères possédant le gène de la malate synthase comprennent les monotrèmes ( ornithorynque ) et les marsupiaux ( opossum ) , mais pas les mammifères placentaires .
L'existence du cycle du glyoxylate chez l'homme n'a pas été établie et il est largement admis que les acides gras ne peuvent pas être convertis directement en glucose chez l'homme. Il a été démontré que le carbone-14 se retrouve dans le glucose lorsqu'il est fourni en acides gras, mais cela peut être attendu de l'incorporation d'atomes marqués dérivés de l'acétyl-CoA dans les intermédiaires du cycle de l'acide citrique qui sont interchangeables avec ceux dérivés d'autres sources physiologiques , tels que les acides aminés glucogéniques. En l'absence d'autres sources glucogéniques, l' acétyl-CoA à 2 carbones issu de l'oxydation des acides gras ne peut pas produire un rendement net de glucose via le cycle de l'acide citrique , car un équivalent de deux atomes de carbone est libéré sous forme de dioxyde de carbone au cours du cycle. Au cours de la cétose , cependant, l'acétyl-CoA des acides gras produit des corps cétoniques , y compris l' acétone , et jusqu'à environ 60 % de l'acétone peut être oxydé dans le foie en précurseurs du pyruvate, l'acétol et le méthylglyoxal . Ainsi, les corps cétoniques dérivés des acides gras pourraient représenter jusqu'à 11% de la néoglucogenèse pendant la famine. Le catabolisme des acides gras produit également de l'énergie sous forme d'ATP nécessaire à la voie de la néoglucogenèse.
Emplacement
Chez les mammifères, on pense que la gluconéogenèse est limitée au foie, aux reins, à l'intestin et aux muscles, mais des preuves récentes indiquent que la gluconéogenèse se produit dans les astrocytes du cerveau. Ces organes utilisent des précurseurs gluconéogènes quelque peu différents. Le foie utilise préférentiellement le lactate, le glycérol et les acides aminés glucogéniques (notamment l' alanine ) tandis que le rein utilise préférentiellement le lactate, la glutamine et le glycérol. Le lactate du cycle de Cori est quantitativement la plus grande source de substrat pour la néoglucogenèse, en particulier pour le rein. Le foie utilise à la fois la glycogénolyse et la gluconéogenèse pour produire du glucose, tandis que le rein utilise uniquement la gluconéogenèse. Après un repas, le foie passe à la synthèse du glycogène , tandis que le rein augmente la néoglucogenèse. L'intestin utilise principalement de la glutamine et du glycérol.
Le propionate est le substrat principal de la néoglucogenèse dans le foie des ruminants, et le foie des ruminants peut utiliser davantage les acides aminés néoglucogéniques (par exemple, l'alanine) lorsque la demande en glucose augmente. La capacité des cellules hépatiques à utiliser le lactate pour la néoglucogenèse diminue du stade préruminant au stade ruminant chez les veaux et les agneaux. Dans le tissu rénal de mouton, des taux très élevés de néoglucogenèse à partir du propionate ont été observés.
Chez toutes les espèces, la formation d' oxaloacétate à partir des intermédiaires du cycle du pyruvate et du TCA est limitée à la mitochondrie, et les enzymes qui convertissent l' acide phosphoénolpyruvique (PEP) en glucose-6-phosphate se trouvent dans le cytosol. La localisation de l'enzyme qui relie ces deux parties de la gluconéogenèse en convertissant l' oxaloacétate en PEP - PEP carboxykinase (PEPCK) - est variable selon les espèces : elle peut être trouvée entièrement dans les mitochondries , entièrement dans le cytosol , ou dispersée de manière uniforme entre les deux, comme c'est le cas chez l'homme. Le transport de PEP à travers la membrane mitochondriale est réalisé par des protéines de transport dédiées ; cependant aucune telle protéine n'existe pour l' oxaloacétate . Par conséquent, chez les espèces dépourvues de PEPCK intra-mitochondrial, l' oxaloacétate doit être converti en malate ou en aspartate , exporté de la mitochondrie et reconverti en oxaloacétate afin de permettre la poursuite de la gluconéogenèse.
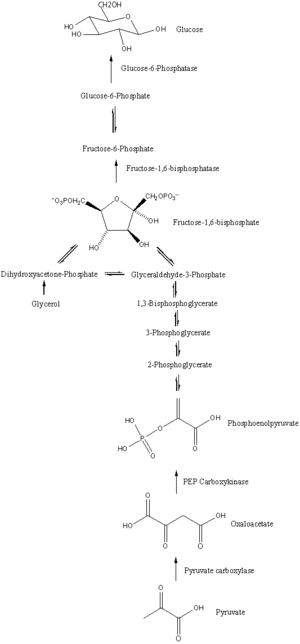
Sentier
La néoglucogenèse est une voie consistant en une série de onze réactions catalysées par des enzymes. La voie commencera soit dans le foie, soit dans les reins, dans les mitochondries ou le cytoplasme de ces cellules, cela dépendant du substrat utilisé. La plupart des réactions sont l'inverse des étapes trouvées dans la glycolyse .
- La néoglucogenèse débute dans les mitochondries avec la formation d'oxaloacétate par la carboxylation du pyruvate. Cette réaction nécessite également une molécule d' ATP et est catalysée par la pyruvate carboxylase . Cette enzyme est stimulée par des niveaux élevés d' acétyl-CoA (produit lors de la β-oxydation dans le foie) et inhibée par des niveaux élevés d'ADP et de glucose.
- L'oxaloacétate est réduit en malate à l' aide de NADH , une étape nécessaire à son transport hors des mitochondries.
- Le malate est oxydé en oxaloacétate à l'aide de NAD + dans le cytosol, où se déroulent les étapes restantes de la néoglucogenèse.
- L'oxaloacétate est décarboxylé puis phosphorylé pour former du phosphoénolpyruvate à l'aide de l'enzyme PEPCK . Une molécule de GTP est hydrolysée en GDP au cours de cette réaction.
- Les prochaines étapes de la réaction sont les mêmes que la glycolyse inversée . Cependant, la fructose 1,6-bisphosphatase convertit le fructose 1,6-bisphosphate en fructose 6-phosphate , en utilisant une molécule d'eau et en libérant un phosphate (dans la glycolyse, la phosphofructokinase 1 convertit F6P et ATP en F1,6BP et ADP ). C'est également l'étape limitante de la gluconéogenèse.
- Le glucose-6-phosphate est formé à partir du fructose 6-phosphate par la phosphoglucoisomérase (l'inverse de l'étape 2 de la glycolyse). Le glucose-6-phosphate peut être utilisé dans d'autres voies métaboliques ou déphosphorylé pour libérer du glucose. Alors que le glucose libre peut facilement se diffuser à l'intérieur et à l'extérieur de la cellule, la forme phosphorylée (glucose-6-phosphate) est bloquée dans la cellule, un mécanisme par lequel les niveaux de glucose intracellulaire sont contrôlés par les cellules.
- La gluconéogenèse finale, la formation de glucose, se produit dans la lumière du réticulum endoplasmique , où le glucose-6-phosphate est hydrolysé par la glucose-6-phosphatase pour produire du glucose et libérer un phosphate inorganique. Comme les deux étapes précédentes, cette étape n'est pas une simple inversion de la glycolyse, dans laquelle l' hexokinase catalyse la conversion du glucose et de l'ATP en G6P et ADP. Le glucose est transporté dans le cytoplasme par des transporteurs de glucose situés dans la membrane du réticulum endoplasmique.
| Métabolisme des monosaccharides courants , y compris la glycolyse , la gluconéogenèse, la glycogenèse et la glycogénolyse |
|---|
Régulation
Alors que la plupart des étapes de la néoglucogenèse sont l'inverse de celles trouvées dans la glycolyse , trois réactions régulées et fortement endergoniques sont remplacées par des réactions plus cinétiquement favorables. Les enzymes hexokinase / glucokinase , phosphofructokinase et pyruvate kinase de la glycolyse sont remplacées par la glucose-6-phosphatase , la fructose-1,6-bisphosphatase et la PEP carboxykinase /pyruvate carboxylase. Ces enzymes sont généralement régulées par des molécules similaires, mais avec des résultats opposés. Par exemple, l' acétyl CoA et le citrate activent les enzymes de la néoglucogenèse (respectivement la pyruvate carboxylase et la fructose-1,6-bisphosphatase), tout en inhibant l'enzyme glycolytique pyruvate kinase . Ce système de contrôle réciproque permet à la glycolyse et à la néoglucogenèse de s'inhiber l'une l'autre et empêche un cycle futile de synthèse du glucose pour seulement le décomposer. La pyruvate kinase peut également être contournée par 86 voies non liées à la gluconéogenèse, dans le but de former du pyruvate puis du lactate ; certaines de ces voies utilisent des atomes de carbone provenant du glucose.
La majorité des enzymes responsables de la néoglucogenèse se trouvent dans le cytosol ; les exceptions sont la pyruvate carboxylase mitochondriale et, chez les animaux, la phosphoénolpyruvate carboxykinase . Ce dernier existe sous la forme d'une isozyme localisée à la fois dans la mitochondrie et le cytosol . Le taux de néoglucogenèse est finalement contrôlé par l'action d'une enzyme clé, la fructose-1,6-bisphosphatase , qui est également régulée par la transduction du signal par l' AMPc et sa phosphorylation.
Le contrôle global de la néoglucogenèse est médié par le glucagon ( libéré lorsque la glycémie est basse ) ; il déclenche la phosphorylation des enzymes et des protéines régulatrices par la protéine kinase A (une kinase régulée par l'AMP cyclique) entraînant une inhibition de la glycolyse et une stimulation de la gluconéogenèse. L'insuline neutralise le glucagon en inhibant la néoglucogenèse. Le diabète de type 2 est marqué par un excès de glucagon et une résistance à l' insuline du corps. L'insuline ne peut plus inhiber l'expression des gènes d'enzymes telles que la PEPCK, ce qui entraîne une augmentation des niveaux d'hyperglycémie dans le corps. Le médicament antidiabétique metformine réduit la glycémie principalement par l'inhibition de la néoglucogenèse, surmontant l'incapacité de l'insuline à inhiber la néoglucogenèse en raison de la résistance à l'insuline.
Des études ont montré que l'absence de production hépatique de glucose n'a pas d'effet majeur sur le contrôle de la concentration plasmatique de glucose à jeun. L'induction compensatoire de la néoglucogenèse se produit dans les reins et l'intestin, induite par le glucagon , les glucocorticoïdes et l'acidose.
Résistance à l'insuline
Dans le foie, la protéine FOX FOXO6 favorise normalement la néoglucogenèse à jeun, mais l' insuline bloque FOXO6 lors de l'alimentation. Dans un état de résistance à l'insuline , l'insuline ne parvient pas à bloquer FOXO6, ce qui entraîne une néoglucogenèse continue même après l'alimentation, entraînant une glycémie élevée ( hyperglycémie ).
La résistance à l'insuline est une caractéristique commune du syndrome métabolique et du diabète de type 2 . Pour cette raison, la néoglucogenèse est une cible du traitement du diabète de type 2, comme le médicament antidiabétique metformine , qui inhibe la formation de glucose néoglucogénique et stimule l'absorption du glucose par les cellules.