Syndrome de Lesch-Nyhan - Lesch–Nyhan syndrome
| Syndrome de Lesch-Nyhan | |
|---|---|
| Autres noms | Goutte juvénile, syndrome d'hyperuricémie primaire, syndrome d'automutilation choréoathétose, hyperuricémie primaire liée à l'X, déficit en HGPRT |
| Spécialité |
Endocrinologie |
| Symptômes | automutilation , dystonie , chorée , spacicité , déficience intellectuelle , hyperuricémie , |
| Complications | insuffisance rénale , anémie mégaloblastique |
| Diagnostic différentiel | infirmité motrice cérébrale , dystonie , syndrome de Cornelia de Lange , autisme , dysautonomie familiale, syndrome de Tourette |
| La fréquence | 1 sur 380 000 |
Le syndrome de Lesch-Nyhan ( LNS ) est une maladie héréditaire rare causée par une déficience de l' enzyme hypoxanthine-guanine phosphoribosyltransférase (HGPRT). Cette carence est due à des mutations du HPRT1 gène situé sur le chromosome X . Le LNS affecte environ 1 naissance vivante sur 380 000. Le trouble a d'abord été reconnu et caractérisé cliniquement par l'étudiant en médecine américain Michael Lesch et son mentor, le pédiatre William Nyhan , à Johns Hopkins .
Le déficit en HGPRT provoque une accumulation d'acide urique dans tous les fluides corporels. La combinaison d'une synthèse accrue et d'une utilisation réduite des purines conduit à des niveaux élevés de production d'acide urique. Cela se traduit à la fois par des taux élevés d'acide urique dans le sang et dans les urines , associés à de graves problèmes de goutte et de reins. Les signes neurologiques comprennent un mauvais contrôle musculaire et une déficience intellectuelle modérée . Ces complications apparaissent généralement au cours de la première année de vie. À partir de la deuxième année de vie, une caractéristique particulièrement frappante du LNS est les comportements d' automutilation , caractérisés par la morsure des lèvres et des doigts. Les symptômes neurologiques comprennent des grimaces faciales, des contorsions involontaires et des mouvements répétitifs des bras et des jambes similaires à ceux observés dans la maladie de Huntington . La cause des anomalies neurologiques reste inconnue. Parce qu'un manque de HGPRT fait que le corps utilise mal la vitamine B 12 , certains hommes peuvent développer une anémie mégaloblastique .
Le LNS est hérité de manière récessive liée à l'X ; la mutation génétique est généralement portée par la mère et transmise à son fils, bien qu'un tiers de tous les cas surviennent de novo (de nouvelles mutations) et n'ont pas d'antécédents familiaux. Le LNS est présent à la naissance chez les bébés garçons. La plupart des personnes atteintes de cette déficience, mais pas toutes, ont de graves problèmes mentaux et physiques tout au long de leur vie. Les cas chez les femmes sont très rares.
Les symptômes causés par l'accumulation d'acide urique ( symptômes de la goutte et des reins ) répondent bien au traitement avec des médicaments tels que l' allopurinol qui réduisent les niveaux d'acide urique dans le sang. Les déficits mentaux et les comportements d'automutilation ne répondent pas bien au traitement. Il n'y a pas de remède, mais de nombreuses personnes atteintes vivent jusqu'à l'âge adulte. Plusieurs nouveaux traitements expérimentaux peuvent soulager les symptômes.
Signes et symptômes
Le LNS est caractérisé par trois caractéristiques principales : un dysfonctionnement neurologique , des troubles cognitifs et comportementaux, y compris l'automutilation, et une surproduction d' acide urique ( hyperuricémie ). Les dommages aux noyaux gris centraux amènent les personnes atteintes à adopter une position d'escrime caractéristique en raison de la nature de la lésion. Certains peuvent également être atteints d' anémie macrocytaire en raison d'une synthèse défectueuse de l'ADN, très probablement en raison d'une synthèse de purine déficiente qui entraîne un retard de la division cellulaire par rapport à l'augmentation de la masse cellulaire. Pratiquement tous les patients sont de sexe masculin ; les mâles souffrent d'un retard de croissance et de puberté , et la plupart développent des testicules rétrécis ou une atrophie testiculaire . Les femmes porteuses courent un risque accru d' arthrite goutteuse, mais ne sont généralement pas affectées par ailleurs.
Surproduction d'acide urique
L'un des premiers symptômes de la maladie est la présence de cristaux d'acide urique ressemblant à du sable dans les couches du nourrisson affecté. La surproduction d'acide urique peut entraîner le développement de cristaux ou de calculs d'acide urique dans les reins , les uretères ou la vessie . De tels cristaux déposés dans les articulations plus tard au cours de la maladie peuvent produire une arthrite semblable à la goutte , avec gonflement et sensibilité. La surproduction d'acide urique est présente à la naissance, mais peut ne pas être reconnue par les méthodes de tests cliniques de routine en laboratoire. La concentration sérique d'acide urique est souvent normale, car les purines en excès sont rapidement éliminées dans les urines. Les cristaux apparaissent généralement sous la forme d'un matériau granuleux orange, ou ils peuvent fusionner pour former plusieurs petites pierres ou de grosses pierres distinctes difficiles à passer. Les calculs, ou calculs, provoquent généralement une hématurie (sang dans les urines) et augmentent le risque d' infection des voies urinaires . Certaines victimes souffrent de lésions rénales dues à ces calculs rénaux . Les calculs peuvent être la caractéristique de présentation de la maladie, mais peuvent passer inaperçus pendant des mois, voire des années.
Atteinte du système nerveux
Les périodes précédant et entourant la naissance sont généralement normales chez les personnes atteintes de LNS. Les caractéristiques de présentation les plus courantes sont une diminution anormale du tonus musculaire ( hypotonie ) et un retard de développement, qui sont évidents vers l'âge de trois à six mois. Les personnes atteintes s'assoient tardivement, alors que la plupart ne rampent ni ne marchent . Le manque de parole est également un trait très commun associé au LNS.
L'irritabilité est le plus souvent remarquée en même temps que les premiers signes d'atteinte du système nerveux. Au cours des premières années de la vie, l' atteinte extrapyramidale provoque des contractions musculaires involontaires anormales telles qu'une perte de contrôle moteur ( dystonie ), des mouvements de contorsion ( choréoathétose ) et une cambrure de la colonne vertébrale ( opisthotonus ). Des signes d' atteinte du système pyramidal , notamment une spasticité, des réflexes hyperactifs ( hyperréflexie ) et des réflexes plantaires extenseurs , se produisent également. La ressemblance avec la paralysie cérébrale athétoïde est apparente dans les aspects neurologiques du LNS. En conséquence, la plupart des individus sont initialement diagnostiqués comme ayant une paralysie cérébrale. Le handicap moteur est si étendu que la plupart des individus ne marchent jamais et deviennent des utilisateurs de fauteuil roulant à vie.
Comportement d'automutilation
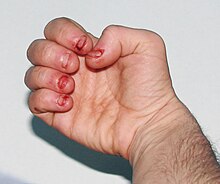
Les personnes concernées sont atteintes de troubles cognitifs et présentent des troubles du comportement qui apparaissent entre deux et trois ans. L' automutilation incontrôlable associée au LNS commence également généralement à l'âge de trois ans. L'automutilation commence par se mordre les lèvres et la langue ; au fur et à mesure que la maladie progresse, les personnes atteintes développent fréquemment des morsures de doigts et des coups de tête. L'automutilation peut augmenter en période de stress. L'automutilation est une caractéristique distinctive de la maladie et est apparente chez 85 % des hommes touchés.
La majorité des individus sont atteints de troubles cognitifs, ce qui est parfois difficile à distinguer des autres symptômes en raison des troubles du comportement et des déficits moteurs associés au syndrome. À bien des égards, les comportements peuvent être considérés comme une extension psychologique de la compulsion à s'automutiler, et incluent le rejet des friandises ou des voyages souhaités, le remboursement de la gentillesse avec de la froideur ou de la rage, le fait de ne pas répondre correctement aux questions du test malgré les études et le désir de réussir. , provoquant la colère des soignants lorsque l'affection est souhaitée.
Des comportements compulsifs se produisent également, y compris l'agressivité, les vomissements , les crachats et la coprolalie (jurer involontairement). Le développement de ce type de comportement est parfois observé au cours de la première année ou de la petite enfance, mais d'autres peuvent ne le développer que plus tard dans la vie.
LNS chez les femmes
Bien que les femmes porteuses soient généralement asymptomatiques , elles subissent une augmentation de l'excrétion d'acide urique et certaines peuvent développer des symptômes d' hyperuricémie et souffrir de goutte dans leurs dernières années. Les tests dans ce contexte n'ont aucune conséquence clinique, mais ils peuvent révéler la possibilité de transmettre le trait aux enfants de sexe masculin. Les femmes peuvent également nécessiter des tests si un enfant de sexe masculin développe le LNS. Dans ce cas, un test négatif signifie que la maladie du fils est le résultat d'une nouvelle mutation et que le risque chez les frères et sœurs n'est pas augmenté.
Les femelles qui portent une copie du gène défectueux sont porteuses avec 50 % de chances de transmettre la maladie à leurs fils. Pour qu'une femme soit affectée, elle aurait besoin de deux copies du gène muté, dont l'une serait héritée de son père. Les hommes atteints de LNS n'ont généralement pas d'enfants en raison des effets débilitants de la maladie. Il est possible qu'une femme hérite d'un chromosome X de son père non affecté, qui porte une nouvelle mutation du gène HGPRT. Dans ces circonstances, une fille pourrait naître avec le LNS, et bien qu'il y ait quelques rapports de ce qui se passe, c'est très rare. L'écrasante majorité des patients atteints de LNS sont des hommes.
Formes moins sévères
Une maladie apparentée moins grave, le déficit partiel en HPRT, est connue sous le nom de syndrome de Kelley-Seegmiller (le syndrome de Lesch-Nyhan implique un déficit total en HPRT). Les symptômes impliquent généralement moins d'atteinte neurologique, mais la maladie provoque toujours la goutte et des calculs rénaux.
La génétique

Le LNS est dû à des mutations du gène HPRT1 , ainsi nommé car il code pour l' enzyme hypoxanthine-guanine phosphoribosyltransférase (HPRT ou HGPRT, EC 2.4.2.8 ). Cette enzyme est impliquée dans les voies biochimiques que le corps utilise pour produire des purines , l'un des composants de l' ADN et de l' ARN . Les défauts de cette enzyme entraînent une augmentation de la production d'acide urique . Le gène HPRT étant situé sur le chromosome X , le LNS est une maladie héréditaire liée à l'X .
Le père d'un homme atteint ne sera pas porteur de l' allèle mutant et n'aura pas la maladie. Un porteur obligatoire serait une femme qui a un fils affecté et un autre parent affecté dans la lignée maternelle.
Si une femme est la première de sa famille à avoir un fils atteint, la règle de Haldane prédit 2/3 de chance qu'elle soit porteuse et 1/3 de chance que le fils ait une nouvelle mutation germinale .
Le risque pour les frères et sœurs d'une personne affectée dépend du statut de porteur de la mère elle-même. Une chance de 50 % est donnée à toute femme porteuse de transmettre la mutation HPRT1 à chaque grossesse . Les fils qui héritent de la mutation seront affectés tandis que les filles qui héritent de la mutation sont porteuses. Par conséquent, à chaque grossesse, une femme porteuse a 25 % de chance d'avoir un homme atteint, 25 % de chance d'avoir une femme porteuse et 50 % de chance d'avoir un homme ou une femme normal.
Les mâles atteints de LNS ne se reproduisent pas en raison des caractéristiques de la maladie. Cependant, si un mâle avec un phénotype moins sévère se reproduit, toutes ses filles sont porteuses et aucun de ses fils ne sera affecté.
Physiopathologie
Comme dans d'autres maladies liées à l'X , les hommes sont touchés car ils ne possèdent qu'une seule copie du chromosome X. Dans le syndrome de Lesch-Nyhan, le gène défectueux est celui de l' hypoxanthine-guanine phosphoribosyltransférase (HPRT), un participant au « recyclage » des nucléotides puriques . Les femmes porteuses ont un deuxième chromosome X, qui contient une copie "normale" de la HPRT, empêchant le développement de la maladie, bien qu'elles puissent avoir un risque accru d'hyperuricémie.
Un grand nombre de mutations de HPRT sont connues. Qui ne diminuent Mutations légèrement la fonction de l'enzyme ne normalement pas la cause de la forme sévère de LNS, mais qui produisent une forme bénigne de la maladie qui présente encore une surproduction purine accompagnée de la sensibilité à la goutte et l' acide urique néphrolithiase .
La formation d'ADN (au cours de la division cellulaire ) nécessite des nucléotides , des molécules qui sont les éléments constitutifs de l'ADN. Les bases puriques ( adénine et guanine ) et pyrimidiques ( thymine et cytosine ) sont liées au désoxyribose et au phosphate et incorporées si nécessaire. Normalement, les nucléotides sont synthétisés de novo à partir d' acides aminés et d'autres précurseurs. Une petite partie, cependant, est « recyclée » à partir de l'ADN dégradé des cellules décomposées. C'est ce qu'on appelle la "voie de récupération".
HGPRT est l'« enzyme de récupération » des purines : elle renvoie l' hypoxanthine et la guanine dans la synthèse de l'ADN. L'échec de cette enzyme a deux résultats :
- Les produits de dégradation des cellules ne peuvent pas être réutilisés et sont donc dégradés. Cela donne lieu à une augmentation de l'acide urique , un produit de dégradation des purines.
- La voie de novo est stimulée par un excès de PRPP (5-phospho-D-ribosyl-1-pyrophosphate ou simplement phosphoribosyl-pyrophosphate).
Auparavant, il n'était pas clair si les anomalies neurologiques du LNS étaient dues à la neurotoxicité de l'acide urique ou à une pénurie relative de "nouveaux" nucléotides puriques au cours des étapes essentielles de la synthèse. Des mutations génétiques affectant les enzymes de la voie de synthèse de novo peuvent éventuellement contribuer à la maladie, bien qu'elles soient rares ou inconnues. L'acide urique a été suggéré comme cause possible de neurotoxicité, mais cela n'est pas prouvé.
Il est important de noter que les preuves suggèrent qu'une ou plusieurs lésions dans les voies dopaminergiques striatales peuvent être au centre des déficits neurologiques, en particulier la dyskinésie choréoathétoïde et l'automutilation. La toxicité de la 6-hydroxydopamine chez les rongeurs peut être un modèle animal utile pour le syndrome, bien que cela ne soit pas prouvé. Cependant, le lien entre la synthèse de la dopamine et de la purine est un nucléotide appelé guanosine triphosphate ou « GTP ». La première étape de la synthèse de la dopamine est la GTP cyclohydrolase , et une déficience significative de cette étape produit un syndrome qui a une neuropathologie similaire au LNS. Ainsi, un manque de HGPRT peut produire un trouble de déficit en nucléotides (spécifiquement : déficit en GTP), entraînant un déficit en dopamine.
Un autre modèle animal de LNS a été proposé pour résulter de dommages oxydatifs, causés par l' hyperuricémie accompagnant LNS. Ceci est basé sur la théorie selon laquelle l'acide urique est un agent réducteur puissant et probablement un antioxydant humain important , en concentration élevée dans le sang. Ainsi, il a été suggéré que les radicaux libres , le stress oxydatif et les espèces réactives de l'oxygène pourraient jouer un certain rôle dans la neuropathologie du SNL.
Cependant, certaines preuves suggèrent contre un rôle de l'acide urique dans la neuropathologie du syndrome de Lesch-Nyhan :
- L'hyperuricémie associée à la goutte primaire classique , qui est causée par une faible clairance rénale d' acide urique plutôt qu'une surproduction d'acide urique, n'est pas associée à une neuropathologie.
- L'hypouricémie survient dans un certain nombre de troubles puriques, en particulier la xanthinurie . Malgré l'absence totale d'acide urique dans le sang, les patients atteints de xanthinurie ne présentent aucune neuropathologie ni aucun autre état pathologique, à l'exception des calculs rénaux causés par l'accumulation de xanthine insoluble à la place de l'acide urique.
De même, l'acide urique ne pénètre pas bien la barrière hémato-encéphalique. Cependant, on pense maintenant que le stress oxydatif dû à l'acide urique figure dans le syndrome métabolique , l' athérosclérose et les accidents vasculaires cérébraux , tous des syndromes associés à des niveaux élevés d'acide urique. De même, la Superoxyde dismutase ("SOD") et les SOD-mimétiques tels que TEMPOL améliorent les effets de l'hyperuricémie. De même, la 6-hydroxydopamine (le modèle animal putatif de la neuropathie de Lesch-Nyhan) agit apparemment comme une neurotoxine par génération d'espèces réactives de l'oxygène. Il se peut que le stress oxydatif induit par une autre oxypurine telle que la xanthine provoque la maladie.
Diagnostic
Lorsqu'un individu affecté a pleinement développé les trois éléments cliniques de la surproduction d'acide urique, du dysfonctionnement neurologique et des troubles cognitifs et comportementaux, le diagnostic de LNS est facilement posé. Le diagnostic est moins facile dans les premiers stades, lorsque les trois caractéristiques ne sont pas encore évidentes. Les signes de comportement d'automutilation (SIB), les résultats de l'analyse généalogique et la nouvelle biologie moléculaire avec des tests génétiques (appelés triade diagnostique pour le LNS), confirment souvent le diagnostic. La suspicion survient souvent lorsque le retard de développement de l'individu est associé à une hyperuricémie. Dans le cas contraire, le diagnostic doit être évoqué lorsqu'un retard de développement est associé à des calculs rénaux ( néphrolithiase ) ou à du sang dans les urines ( hématurie ), provoqués par des calculs d'acide urique. Dans la plupart des cas, le syndrome de Lesch-Nyhan est suspecté pour la première fois lorsqu'un comportement d'automutilation se développe. Cependant, les comportements d'automutilation se produisent dans d' autres conditions, y compris non spécifique de déficience intellectuelle , l' autisme , le syndrome de Rett , le syndrome de Cornelia de Lange , le syndrome de Tourette , la dysautonomie familiale , choreoacanthocytosis , la neuropathie sensorielle y compris le type de neuropathie sensorielle héréditaire 1, et plusieurs troubles psychiatriques. Parmi ceux-ci, seuls les individus atteints du syndrome de Lesch-Nyhan, du syndrome de de Lange et de la dysautonomie familiale présentent de manière récurrente une perte de tissu en conséquence. Se mordre les doigts et les lèvres est une caractéristique définitive du syndrome de Lesch-Nyhan; dans d'autres syndromes associés à l'automutilation, les comportements consistent généralement à se cogner la tête et à s'automutiler non spécifique, mais pas à se mordre les joues, les lèvres et les doigts. Le syndrome de Lesch-Nyhan ne doit être clairement pris en compte que lorsqu'un comportement d'automutilation s'accompagne d'une hyperuricémie et d'un dysfonctionnement neurologique.
Approche diagnostique
Le rapport de concentration de l' urate à la créatinine (produit de dégradation du phosphate de créatine dans le muscle) dans l'urine est élevé. C'est un bon indicateur de surproduction d'acide. Chez les enfants de moins de dix ans atteints de LNS, un rapport urate/créatinine supérieur à deux est généralement observé. Une excrétion d'urate sur vingt-quatre heures supérieure à 20 mg/kg est également typique mais n'est pas diagnostique . L'hyperuricémie (concentration sérique d'acide urique > 8 mg/dL) est souvent présente mais pas suffisamment fiable pour le diagnostic. L'activité de l'enzyme HGPRT dans les cellules de tout type de tissu (p. ex., sang , fibroblastes cultivés ou lymphoblastes ) inférieure à 1,5 % de l'activité enzymatique normale confirme le diagnostic de syndrome de Lesch-Nyhan. Les études de génétique moléculaire des mutations du gène HPRT peuvent confirmer le diagnostic et sont particulièrement utiles pour les « tests de porteurs » ultérieurs chez les femmes à risque telles que les proches parents du côté féminin.
Essai
L'utilisation de tests biochimiques pour la détection des porteurs est techniquement exigeante et peu utilisée. Les analyses biochimiques qui ont été effectuées sur les bulbes pileux de femmes à risque ont eu un petit nombre de résultats faussement positifs et faussement négatifs. Si seule une femelle porteuse présumée est disponible pour les tests de mutation, il peut être approprié de cultiver ses lymphocytes dans la 6-thioguanine (un analogue de la purine ), ce qui permet uniquement aux cellules déficientes en HGPRT de survivre. Une fréquence mutante de 0,5 à 5,0 × 10 -2 est trouvée chez les femelles porteuses, tandis qu'une femelle non porteuse a une fréquence de 1 à 20 × 10 -6 . Cette fréquence est généralement diagnostique en elle-même.
Les tests de génétique moléculaire sont la méthode de test la plus efficace, car HPRT1 est le seul gène connu pour être associé au LNS. Les individus qui présentent le phénotype Lesch-Nyhan complet ont tous des mutations dans le gène HPRT1. L'analyse des séquences de l' ARNm est disponible en clinique et peut être utilisée pour détecter les mutations HPRT1 chez les hommes atteints du syndrome de Lesch-Nyhan. Des techniques telles que la RT-PCR, la PCR génomique multiplex et l'analyse de séquences (ADNc et ADN génomique), utilisées pour le diagnostic des maladies génétiques, sont réalisées sur une base de recherche. Si les tests de RT-PCR résultat en ADNc montrant l'absence d'un ensemble exon ou exons, puis le test PCR génomique multiplex est effectuée. Le test PCR génomique multiplex amplifie les neuf exons du gène HPRT1 sous forme de huit produits PCR. Si l'exon en question est supprimé, la bande correspondante sera absente de la PCR multiplex. Cependant, si l'exon est présent, l'exon est séquencé pour identifier la mutation, provoquant ainsi l'exclusion de l'exon de l'ADNc. Si aucun ADNc n'est créé par RT-PCR, alors une PCR multiplex est effectuée sur la notion que la plupart ou la totalité du gène est oblitéré.
Traitement
Le traitement du LNS est symptomatique. La goutte peut être traitée avec de l' allopurinol pour contrôler les quantités excessives d'acide urique . Les calculs rénaux peuvent être traités par lithotritie , une technique permettant de briser les calculs rénaux à l'aide d'ondes de choc ou de faisceaux laser. Il n'existe pas de traitement standard pour les symptômes neurologiques du SNL. Certains peuvent être soulagés avec les médicaments carbidopa / lévodopa , diazépam , phénobarbital ou halopéridol .
Il est essentiel que la surproduction d'acide urique soit contrôlée afin de réduire le risque de néphropathie , de lithiase rénale et d'arthrite goutteuse. Le médicament allopurinol est utilisé pour arrêter la conversion des oxypurines en acide urique et prévenir le développement de tophi arthritiques ultérieurs (produits après une goutte chronique), de calculs rénaux et de néphropathie , la maladie rénale qui en résulte. L'allopurinol est pris par voie orale, à une dose typique de 3 à 20 mg/kg par jour. La dose est ensuite ajustée pour ramener le taux d'acide urique dans la plage normale (<3 mg/dL). La plupart des personnes touchées peuvent être traitées par l'allopurinol tout au long de leur vie.
Aucun médicament n'est efficace pour contrôler les caractéristiques motrices extrapyramidales de la maladie. La spasticité , cependant, peut être réduite par l'administration de baclofène ou de benzodiazépines .
Il n'y avait auparavant aucune méthode efficace de traitement pour les aspects neurocomportementaux de la maladie. Même les enfants traités dès la naissance par l'allopurinol développent des problèmes comportementaux et neurologiques, bien qu'ils n'aient jamais eu de concentrations sériques élevées d'acide urique. Les comportements d'automutilation et autres sont mieux gérés par une combinaison d'interventions médicales, physiques et comportementales. L'automutilation est souvent réduite par l'utilisation de moyens de contention. Soixante pour cent des personnes se font extraire les dents afin d'éviter l'automutilation, ce que les familles ont trouvé comme une technique de gestion efficace. Parce que le stress augmente l'automutilation, la gestion du comportement par des techniques aversives (qui réduiraient normalement l'automutilation) augmente en fait l'automutilation chez les personnes atteintes de LNS. Presque toutes les personnes touchées ont besoin de moyens de contention pour éviter de s'automutiler, et le sont plus de 75 % du temps. Ceci est souvent à leur propre demande et implique parfois des contraintes qui semblent inefficaces, car elles n'empêchent pas physiquement de mordre. Les familles rapportent que les personnes affectées sont plus à l'aise lorsqu'elles sont entravées.
Le Matheny Medical and Educational Center [2] à Peapack, NJ, compte six patients atteints du syndrome de Lesch-Nyhan, considéré comme la plus grande concentration de cas de LNS en un seul endroit, et est reconnu comme la principale source d'information sur les problèmes de soins.
Le traitement des patients atteints de LNS, selon Gary E. Eddey, MD, directeur médical, devrait inclure : 1) L'utilisation judicieuse des dispositifs de protection ; 2) Utilisation d'une technique comportementale communément appelée « ignorance sélective » avec réorientation des activités ; et 3) l'utilisation occasionnelle de médicaments.
Un article paru dans le numéro du 13 août 2007 du magazine The New Yorker , écrit par Richard Preston , discute de la « stimulation cérébrale profonde » comme traitement possible. Elle a été réalisée sur quelques patients atteints du syndrome de Lesch-Nyhan par le Dr Takaomi Taira à Tokyo et par un groupe en France dirigé par le Dr Philippe Coubes. Certains patients ont présenté une diminution des symptômes d'automutilation spastique. La technique a été développée pour traiter les personnes atteintes de la maladie de Parkinson , selon Preston, il y a plus de 20 ans. Le traitement implique une chirurgie invasive pour placer des fils qui transportent un courant électrique continu dans une région spécifique du cerveau.
Une avancée encourageante dans le traitement des aspects neurocomportementaux du SNL a été la publication dans le numéro d'octobre 2006 du Journal of Inherited Metabolic Disease d'une thérapie expérimentale donnant de la S-adénosyl-méthionine (SAMe) par voie orale . Ce médicament est un précurseur de nucléotide qui fournit une purine facilement absorbée, connue pour être transportée à travers la barrière hémato-encéphalique . Il a été démontré que l'administration de SAMe à des patients adultes atteints de LNS améliore le comportement neuro-comportemental et d'autres attributs neurologiques. Le médicament est disponible sans ordonnance et a été largement utilisé pour la dépression , mais son utilisation pour le traitement du SNL ne doit être entreprise que sous surveillance médicale stricte, car les effets secondaires sont connus.
Pronostic
Le pronostic des personnes atteintes de LNS sévère est mauvais. La mort est généralement due à une insuffisance rénale ou à des complications d'hypotonie, au cours de la première ou de la deuxième décennie de la vie. Les formes moins sévères ont un meilleur pronostic.
Histoire
Michael Lesch était étudiant en médecine à Johns Hopkins et William Nyhan , pédiatre et généticien biochimique, était son mentor lorsque les deux ont identifié le LNS et son hyperuricémie associée chez deux frères atteints, âgés de 4 et 8 ans. Lesch et Nyhan ont publié leurs résultats en 1964. En trois ans, la cause métabolique a été identifiée par J. Edwin Seegmiller et ses collègues du NIH .
Les références
Liens externes
- Syndrome de Lesch-Nyhan au bureau des maladies rares du NIH
- Entrée GeneReview/NIH/UW sur le syndrome de Lesch-Nyhan
- Institut national de la santé de l'enfant et du développement humain (NICHD)
| Classification | |
|---|---|
| Ressources externes |